
【題目】用標準鹽酸滴定未知濃度的NaOH溶液,如果測得結果偏低,則產(chǎn)生誤差的原因可能是下列敘述中的( )
A.滴定前酸式滴定管尖嘴部分有氣泡,滴定終止時氣泡消失
B.錐形瓶用蒸餾水洗凈后,未經(jīng)干燥即進行滴定
C.滴定過程中,錐形瓶中有溶液濺出
D.酸式滴定管未用標準鹽酸潤洗
【答案】C
【解析】解:A.滴定前酸式滴定管尖嘴部分有氣泡,滴定終止時氣泡消失,造成V(標準)偏大,根據(jù)c(待測)= ![]() 分析,可知c(待測)偏大,故A錯誤; B.錐形瓶用蒸餾水洗凈后,未經(jīng)干燥即進行滴定,待測液的物質的量不變,V(標準)不變,根據(jù)c(待測)=
分析,可知c(待測)偏大,故A錯誤; B.錐形瓶用蒸餾水洗凈后,未經(jīng)干燥即進行滴定,待測液的物質的量不變,V(標準)不變,根據(jù)c(待測)= ![]() 分析,可知c(待測)不變,故B錯誤;
分析,可知c(待測)不變,故B錯誤;
C.滴定過程中,錐形瓶中有溶液濺出,待測液的物質的量偏小,造成V(標準)偏小,根據(jù)c(待測)= ![]() 分析,可知c(待測)偏小,故C正確;
分析,可知c(待測)偏小,故C正確;
D.酸式滴定管未用標準鹽酸潤洗,標準鹽酸被稀釋,造成V(標準)偏大,根據(jù)c(待測)= ![]() 分析,可知c(待測)偏大,故D錯誤;
分析,可知c(待測)偏大,故D錯誤;
故選C.
【考點精析】解答此題的關鍵在于理解酸堿中和滴定的相關知識,掌握中和滴定實驗時,用蒸餾水洗過的滴定管先用標準液潤洗后再裝標準液;先用待測液潤洗后在移取液體;滴定管讀數(shù)時先等一二分鐘后再讀數(shù);觀察錐形瓶中溶液顏色的改變時,先等半分鐘顏色不變后即為滴定終點.


科目:高中化學 來源: 題型:
【題目】向物質的量濃度均為1mol/L的HCl、AlCl3、MgC12、NH4Cl混合溶液中逐滴加入1mol/L的NaOH溶液,得到如圖圖像。下列有關說法正確的是

A. 沉淀的最大物質的量為2mol
B. c-d段會產(chǎn)生標況下22.4LNH3
C. d-e段發(fā)生的反應為Al3++40H-=AlO2-+2H2O
D. 滴加NaOH溶液過程中,微粒反應的先后順序是H+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等體積的SO2和Cl2充分混合,通入加有品紅的氯化鋇溶液,可觀察到的現(xiàn)象是( )
A.溶液快速褪色B.溶液緩慢褪色C.生成白色沉淀D.生成淺黃色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數(shù),下列說法正確的是
A. 2.4g金屬鎂所含電子數(shù)目為0.2NA
B. 16g CH4所含原子數(shù)目為NA
C. 17gNH3所含質子數(shù)目為17 NA
D. 18g水所含分子數(shù)目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用某溶液浸濕濾紙后置于集氣瓶口,以檢驗瓶中是否收集滿二氧化硫氣體。則該溶液是( )
A.氯化鋇溶液B.酸性高錳酸鉀溶液
C.碘化鉀淀粉溶液D.澄清石灰水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以粗鎳(含少量Fe和Cr雜質)為原料制備醋酸鎳的工藝流程如下:
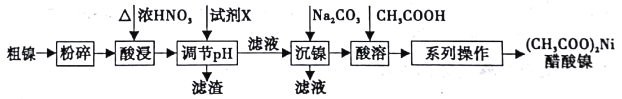
已知:
離子 | Fe3+ | Cr3+ | Ni2+ |
開始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下問題:
(1)粗鎳原料在酸浸前粉碎的原因是_______________。
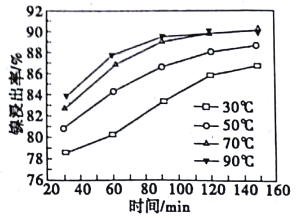
(2)酸浸過程中,鎳浸出率隨時間變化如圖。酸浸的最佳溫度與時間分別為_____℃、_____min。
(3)酸浸中Ni和濃硝酸反應的化學方程式為___________。
(4)加人試劑X為_____(填下列提供試劑的序號),可調節(jié)溶液pH至______(填pH范圍)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)進入“沉鎳”步驟的濾液中c(Ni2+)=2.0mol/L,若要處理1L該濾液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],則需要加入Na2CO3固體的質量最少為______g。(已知NiCO3的Ksp=9.6×10-6,結果保留小數(shù)點后2位有效數(shù)字)
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com