
【題目】NiSO4![]() 6H2O易溶于水,其溶解度隨溫度升高明顯增大。以電鍍廢渣(主要成分是NiO,還有CuO、FeO等少量雜質)為原料制備該晶體的流程如下,下列說法錯誤的是
6H2O易溶于水,其溶解度隨溫度升高明顯增大。以電鍍廢渣(主要成分是NiO,還有CuO、FeO等少量雜質)為原料制備該晶體的流程如下,下列說法錯誤的是
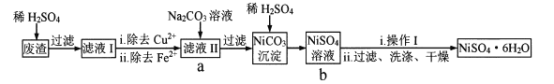
A. 溶解廢渣時不能用稀鹽酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”為蒸發濃縮、冷卻結晶
 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:
【題目】硫酰氯(SO2Cl2)常作氯化劑或氯磺化劑,用于制作藥品、染料、表面活性劑等。有關物質的部分性質如下表:

實驗室用干燥而純浄的二氧化硫和氯氣合成硫酰氯,反應的熱化學方程式為:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反應裝置如圖所示(夾持儀器已省略),請回答有關問題:

(1)儀器B的名稱為________;
(2)儀器A的作用是_______;
(3)裝置乙中盛放的試劑為______,在實驗室用氫氧化鈉溶液吸收多余硫酰氯的離子反應方程式為______;
(4)為提高本實驗中硫酰氯的產率,在實驗操作中需要注意的事項有_______(填序號);
①先通冷凝水,再通氣體 ②控制氣流速率,宜慢不宜快
③若三頸燒瓶發燙,可適當降溫 ④加熱三頸燒瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解獲得,該反應的化學方程式為:2ClSO3H=H2SO4+SO2Cl2,此方法得到的產品中會混有硫酸。
①分解產物中分離出硫酰氯的實驗操作名稱為____。
②某同學為檢驗硫酰氯產品中是否混有硫酸設計實驗如下:取少量產品溶于水,加入鹽酸酸化的氯化鋇溶液,振蕩,觀察到有白色沉淀生成,則認為產品中含有硫酸。該同學的結論是否正確,請說明理由____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中,反應 aA(氣)![]() bB(氣)達平衡后,保持溫度不變,將容器體積減小1/2,當達到新的平衡時,B的濃度是原來的1.5倍,則
bB(氣)達平衡后,保持溫度不變,將容器體積減小1/2,當達到新的平衡時,B的濃度是原來的1.5倍,則
A. 平衡向逆反應方向移動 B. 物質A的轉化率增大
C. 物質B的質量分數增加 D. a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉( Na2MoO4)可與重金屬鹽產生沉淀,是目前應用較多的一種新型水處理劑。利用精鉬礦(主要成分是MoS2,含少量PbS等)來制取鉬酸鈉晶體的工藝流程如下圖所示。

請回答下列問題:
(1)混合氣A中含有一種大氣污染物,其化學式為___________。
(2)焙燒的過程中采用如圖1所示的“多層逆流焙燒”。

①多層逆流焙燒的優點是___________(任答兩點)。
②依據如圖2,寫出第6~12層MoO2參加反應的化學方程式___________。
(3)寫出堿浸時發生反應的離子方程式___________。
(4)PbS與H2O2反應時,溫度高于40℃后,反應速率反而減慢,原因是___________。
(5)流程圖中“除SO42-”的過程中,當 BaMoO4開始沉淀時,SO42-的去除率為97.0%,已知原 Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L, Ksp(BaSO4)=1.0×10-10, 則Ksp(BaMoO4)=___________。(過程中溶液體積變化忽略不計)
(6)鋰和二硫化鉬形成的二次電池的總反應為:xLi+nMoS2![]() Lix(MoS2)n,則電池放電時的正極反應式是___________。
Lix(MoS2)n,則電池放電時的正極反應式是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學一一選修5:有機化學基礎]
有機化合物K是有機合成中的一種重要的中間體,K的合成路線如下(部分產物及條件略去):

已知:
(1)A的核磁共振氫譜只有一組峰,A中官能團的名稱為___________。
(2)B→C和(D+H)→K的反應類型分別是___________、___________。
(3)H的結構簡式為___________。
(4)D的系統命名為___________。
(5)G→I的第①步反應方程式為___________;I→J的反應方程式為___________。
(6)同時滿足下列條件的K的同分異構體有___________種(不考慮立體異構,也不包括K)。
①與K具有相同的官能團 ②分子中有一個甲基 ③具有六元碳環結構
(7)參照上述合成路線,設計一條由乙醛和乙炔為原料制備![]() 的合成路線(無機試劑任選):
的合成路線(無機試劑任選):![]() ___________。
___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】FeCl3是重要的化工原料,無水氯化鐵在300℃以上升華,遇潮濕空氣極易潮解
(1)制備無水氯化鐵

①儀器X的名稱為____。
②裝置的連接順序為a→____→i,k→____(按氣流方向,用小寫字母表示)。
③實驗結束后,取少量F中的固體加水溶解,經檢測發現溶液中含有Fe2+,其原因為____。
(2)探究FeCl3與SO2的反應
已知反應體系中存在下列兩種化學變化:
(i) Fe3+與SO2發生絡合反應生成Fe(SO2)62+(紅棕色);
(ii) Fe3+與SO2發生氧化還原反應,其離子方程式為①____

②_________
③_________
④實驗結論:反應(i)、(ii)的活化能大小關系是:E(i)____E(ii)(填“>”、 “<”或“=”,下同),平衡常數大小關系是:K(i)__________K(ii)。
⑤另取5 mL l mol![]() L-l FeC13溶液,先滴加2滴濃鹽酸,再通入SO2至飽和。幾分鐘后,溶液由黃色變為淺綠色,由此可知:促使氧化還原反應(ii)快速發生可采取的措施是____。
L-l FeC13溶液,先滴加2滴濃鹽酸,再通入SO2至飽和。幾分鐘后,溶液由黃色變為淺綠色,由此可知:促使氧化還原反應(ii)快速發生可采取的措施是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某溫度下,將H2和I2各1 mol的氣態混合物充入1 L的密閉容器中,發生反應:H2(g)+I2(g)![]() 2HI(g) ΔH<0; 5 min后達到平衡狀態,測得c(H2)=0.9 mol·L-1,則下列結論中,不能成立的是
2HI(g) ΔH<0; 5 min后達到平衡狀態,測得c(H2)=0.9 mol·L-1,則下列結論中,不能成立的是
A. 平衡時H2、I2的轉化率相等
B. 若將容器溫度提高,其平衡常數K一定增大
C. 其他條件不變再向容器中充入少量H2,I2的轉化率提高
D. 從反應開始至平衡的過程中,v(HI)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中,反應aA(g)![]() bB(g) 達平衡后,保持溫度不變,將容器體積增加一倍,當達到新的平衡時,B的濃度是原來的60%,則錯誤的是( )
bB(g) 達平衡后,保持溫度不變,將容器體積增加一倍,當達到新的平衡時,B的濃度是原來的60%,則錯誤的是( )
A. 平衡向正反應方向移動了 B. 物質A的轉化率增大了
C. 物質B的質量分數增加了 D. a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)標準狀況下:①0.3mol氨氣 ②6.02×1022個CO2分子 ③7.3gHCl ④0.2molCH4。體積最大的是___;密度最大的是___;質量最大的是___。(填序號)
(2)相同質量的SO2與SO3,其物質的量之比為___,氧元素的質量之比為___,原子總數之比為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com