
【題目】已知:2KMnO4![]() K2MnO4+MnO2+O2↑,將0.1moKMnO4固體加熱一段時間后,收集到amolO2;向反應后殘留的固體中加入足量的濃鹽酸,又收集到bmolCl2,此時Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能與濃鹽酸反應并生成Mn2+)。
K2MnO4+MnO2+O2↑,將0.1moKMnO4固體加熱一段時間后,收集到amolO2;向反應后殘留的固體中加入足量的濃鹽酸,又收集到bmolCl2,此時Mn元素全部以Mn2+的形式存在于溶液中(注:KMnO4和K2MnO4以及MnO2都能與濃鹽酸反應并生成Mn2+)。
(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反應中的還原產物是_____(填化學式),反應中若產生0.3mol的氣體則有________mol的電子轉移。
(2)a+b的最大值為________,a+b最小值為________。
【答案】MnCl2 0.6 0.25 0.2
【解析】
(1)元素化合價降低發生還原反應得到還原產物;根據Cl元素化合價變化計算轉移電子;
(2)KMnO4固體,加熱一段時間后,收集到amol氧氣,在反應后的殘留固體中加入足量的濃鹽酸,繼續加熱,收集到氣體bmol氯氣,根據電子轉移守恒,整個過程中,Mn元素得到電子數等于O元素、Cl元素失去的電子,則有:0.1×(7-2)=4a+2b,整理得a+b=0.25-a,當高氯酸鉀沒有分解時,(a+b)達最大值,當高錳酸鉀完全分解生成氧氣時,生成氧氣最多,生成氯氣最少,根據方程式計算氧氣最大值,進而確定(a+b)的最小值。
(1)反應中Mn元素化合價由+7價變為+2價,化合價降低,得到電子,被還原,所以MnCl2是還原產物;產生0.3mol的氯氣時,轉移電子為n(e-)=0.3mol×2×[0-(-1)]=0.6mol;
(2)KMnO4固體加熱一段時間后,收集到amol氧氣,在反應后的殘留固體中加入足量的濃鹽酸,繼續加熱,收集到bmol氯氣,根據電子轉移守恒,整個過程中,Mn元素獲得電子等于O元素、Cl元素失去的電子,則有:0.1×(7-2)=4a+2b,整理可得a+b=0.25-a,當高氯酸鉀沒有分解時,(a+b)達最大值,此時a=0,則(a+b)的最大值=0.25;當高錳酸鉀完全分解生成氧氣時,生成氧氣最多,生成氯氣最少,由2KMnO4![]() K2MnO4+MnO2+O2↑,可知生成氧氣最大的物質的量為0.1mol×
K2MnO4+MnO2+O2↑,可知生成氧氣最大的物質的量為0.1mol×![]() =0.05mol,則a+b≥0.25-0.05=0.2,故(a+b)的最小值為0.2。
=0.05mol,則a+b≥0.25-0.05=0.2,故(a+b)的最小值為0.2。


 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:
【題目】常溫下,向20mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液40mL,溶液中含碳元素的各種微粒(CO2逸出未畫出)的物質的量分數隨溶液pH變化的部分情況如圖所示,下列說法錯誤的是( )

A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常數Kh1=2×10-4,當溶液的pH=10時,溶液中c(HCO3-):c(CO32-)=2:1
C.pH=7時溶液中各種離子其物質的量濃度的大小關系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.當混合液pH≈6時,開始放出CO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正丁醚常用作有機反應的溶劑。實驗室制備正丁醚的反應和主要實驗裝置如下:
2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
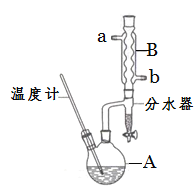
反應物和產物的相關數據如下:
相對分子質量 | 沸點/℃ | 密度/(g·cm—3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
合成反應:
①將6 mL濃硫酸和37 g正丁醇,按一定順序添加到A中,并加幾粒沸石。
②加熱A中反應液,迅速升溫至135℃,維持反應一段時間。
分離提純:
③待A中液體冷卻后將其緩慢倒入盛有70 mL水的分液漏斗中,振搖后靜置,分液得粗產物。
④粗產物依次用40 mL水、20 mL NaOH溶液和40 mL水洗滌,分液后加入約3 g無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣。
⑤將上述處理過的粗產物進行蒸餾,收集餾分,得純凈正丁醚11 g。
請回答:
(1)步驟①中濃硫酸和正丁醇的添加順序為_____________________________。
(2)加熱A前,需先從________(填“a”或“b”)口向B中通入水。
(3)步驟③的目的是初步洗去_____,振搖后靜置,粗產物應在分液漏斗的____口(填“上”或“下”)分離出。
(4)步驟④中最后一次水洗的作用為___________________________________。
(5)步驟⑤中,加熱蒸餾時應收集________(填選項字母)左右溫度的餾分。
a. 100 ℃ b. 117 ℃ c. 135 ℃ d . 142 ℃
(6)反應過程中會觀察到分水器中收集到液體物質,且分為上下兩層,隨著反應的進行,分水器中液體逐漸增多至充滿液體時,上層液體會從左側支管自動流回A。分水器中上層液體的主要成分是___________,下層液體的主要成分是_________。
(7)本實驗中,正丁醚的產率為_________%。(保留2位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的 Fe、FeO、![]() 的混合物中,加入 100mL1mol/L 的鹽酸,恰好使混合物完全溶解,放出224mL(標準狀況)的氣體,所得溶液中,加入 KSCN 溶液無血紅色出現。若用足量的 CO 在高溫下還原 相同質量的混合物,能得到鐵的質量為( )
的混合物中,加入 100mL1mol/L 的鹽酸,恰好使混合物完全溶解,放出224mL(標準狀況)的氣體,所得溶液中,加入 KSCN 溶液無血紅色出現。若用足量的 CO 在高溫下還原 相同質量的混合物,能得到鐵的質量為( )
A.2.8gB.5.6gC.11.2gD.無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粉末狀試樣A是由等物質的量的MgO和Fe2O3組成的混合物。進行如下實驗:
①取適量A進行鋁熱反應,產物中有單質B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1鹽酸中,得溶液C;
③將①中得到的單質B和溶液C反應,放出1.12 L(標準狀況)氣體,同時生成溶液D,還殘留有固體物質B;
④用KSCN溶液檢驗時,溶液D不變色。
請填空:
(1)①中引發鋁熱反應的實驗操作是:____________,產物中單質B是________。
(2)②中所發生的各反應的化學方程式為____________________、________________。
(3)③中所發生的各反應的離子方程式為___________________、_____________________。
(4)若溶液D的體積仍視為0.15 L,則該溶液中c(Mg2+)為________,c(Fe2+)為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研發了一種室溫下“可呼吸”的Na—CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na![]() 2Na2CO3+C。下列說法錯誤的是
2Na2CO3+C。下列說法錯誤的是

A. 放電時,ClO4-向負極移動
B. 充電時釋放CO2,放電時吸收CO2
C. 放電時,正極反應為:3CO2+4e =2CO32-+C
D. 充電時,正極反應為:Na++e=Na
查看答案和解析>>
科目:高中化學 來源: 題型:
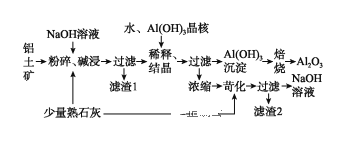
【題目】某鋁土礦中主要含有Al2O3、Al(OH)3還含有Fe2O3等雜質。利用拜耳法生產氧化鋁的流程如圖所示:
請回答下列問題:
(1)粉碎后的鋁土礦堿浸時應在較高溫度下進行,其目的是____________________。濾渣1的主要成分為________________。
(2)Al2O3與NaOH溶液反應的離子方程式為____________________________________。
(3)加Al(OH)3晶核的目的是促進Al(OH)3的析出。上述“稀釋、結晶”工藝,也可用通入足量的_________氣體的方法來代替。(已知:通入該氣體后,其產物之一可用來做發酵粉)。
(4)焙燒過程中發生的化學方程式為_________________________________。
(5)濃縮所得的NaOH溶液由于吸收了空氣中的CO2而含有雜質,該雜質可通過苛化(即與少量熟石灰反應)反應除去,寫出苛化反應的化學方程式:_________________________________________________。
(6)該生產流程能實現____________________(填化學式)的循環利用。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明礬可用于制取鉀肥和冶煉鋁,具體工藝流程如下圖所示:
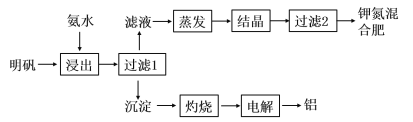
(1)“浸出”反應的離子方程式為__________________________________。“浸出”所用稀氨水濃度為6mol/L,則配制100mL該氨水需12mol/L的濃氨水的體積為______mL,若量取該濃氨水時俯視刻度線,會導致配制的稀氨水濃度________(填“偏高”、“偏低”或“無影響”)。
(2)檢驗“過濾1”所得沉淀是否洗凈的實驗方法是_______________________________。
(3)請寫出“電解”熔融氧化鋁制取金屬鋁的化學方程式________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知鎵是鋁同族下一周期的元素。砷化鎵的晶胞結構如圖所示。試回答:
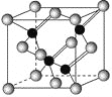
(1)鎵的基態原子的電子排布式是______。
(2)砷化鎵晶胞中所包含的砷原子(白色球)個數為___,與同一個鎵原子相連的砷原子構成的空間構型為____。
(3)N、P、As處于同一主族,其氫化物沸點由高到低的順序是___ (用氫化物分子式表示)。
(4)砷化鎵可由(CH3)3Ga和AsH3在700 ℃時制得。(CH3)3Ga中鎵原子的雜化方式為____。
(5)比較二者的第一電離能:As____Ga(填“<”、“>”或“=”)。
(6)下列說法正確的是__(填字母)。
A.砷化鎵晶胞結構與NaCl相同 B.電負性:As>Ga C.砷化鎵晶體中含有配位鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com