
【題目】硒(Se)是人體健康必需的一種微量元素。已知Se的原子結構示意圖為: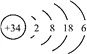 下列說法不正確的是
下列說法不正確的是
A. 該原子的質量數為34 B. 該元素處于第四周期第ⅥA族
C. SeO2既有氧化性又有還原性 D. 酸性:HBrO4 > H2SeO4
科目:高中化學 來源: 題型:
【題目】現有25℃時0.1mol/L的氨水.請回答以下問題:
(1)若向氨水中加入少量硫酸銨固體,此時溶液中 ![]() (填“增大”、“減小”或“不變”);
(填“增大”、“減小”或“不變”);
(2)若向氨水中加入稀硫酸,使其恰好中和,寫出反應的離子方程式;所得溶液的pH7(填“>”、“<”或“=”),用離子方程式表示其原因;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此時c(NH4+)=amol/l,則c(SO ![]() )=;
)=;
(4)若向氨水中加入pH=1的硫酸,且氨水與硫酸的體積比為1:1,則所得溶液中各離子物質的量濃度由大到小的關系是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組為了研究外界條件對化學反應速率的影響,進行了如下實驗:【實驗原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【實驗內容及記錄】
實驗編號 | 室溫下,試管中所加試劑及其用量/mL | 溶液褪至無色所需時間/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
請回答:
(1)根據表中的實驗數據,可以得到的結論是 .
(2)利用實驗1中的數據,計算用KMnO4表示的化學反應速率為 .
(3)該小組同學根據經驗繪制了n(Mn2+)隨時間變化的趨勢如圖1所示,但有同學查閱已有的實驗資料發現,該實驗過程中n(Mn2+)隨時間變化的實際趨勢如圖2所示.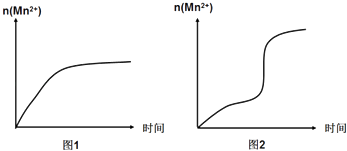
該小組同學根據圖2所示信息提出了新的假設,并繼續進行實驗探究.
①該小組同學提出的假設是 .
②請你幫助該小組同學完成實驗方案,并填寫表中空白
實驗編號 | 室溫下,試管中所加試劑及其用量 | 再向試管中加入某種固體 | 溶液褪至無色所需時間/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
③若該小組同學提出的假設成立,應觀察到現象.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl﹣和Fe3+ .
(1)如果以單位質量的氧化劑所得到的電子數來表示消毒效率,那么,ClO2、Na2FeO4、Cl2三種消毒殺菌劑的消毒效率由大到小的順序是>> .
(2)Na2FeO4溶于水會放出一種無色無味氣體,其殺菌消毒、吸附水中的懸浮雜質的原理可用離子方程式表示為 .
(3)工業以CH3OH與NaClO3為原料在酸性條件下制取ClO2 , 同時產生CO2氣體,已知該反應分為兩步進行,第一步為2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①寫出第二步反應的離子方程式 .
②工業生產時需在反應物中加少量Cl﹣ , 其作用是 .
③生產中會發生副反應ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若測得反應后的混合氣體中Cl2的體積分數為3/73,則起始投料時CH3OH與NaClO3的物質的量之比為 .
(4)已知二氧化氯是一種黃綠色有刺激性氣味的氣體,其熔點為﹣59℃,沸點為11.0℃,易溶于水.ClO2也可以看做是亞氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工業上用稍潮濕的KClO3和草酸在60℃時反應制得.某學生用如圖所示的裝置模擬工業制取及收集ClO2 , 其中A為ClO2的發生裝置,B為ClO2的凝集裝置,C為尾氣吸收裝置.請問:①A部分還應添加溫度控制(如水浴加熱)裝置,B部分還應補充什么裝置;
②C中應裝的試劑為 . C中發生反應的化學方程式為: . 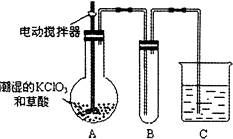
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學做如下實驗,以檢驗反應中的能量變化.
實驗中發現反應后(a)中溫度升高,由此可以判斷(a)中反應是________熱反應;(b)中溫度降低,根據能量守恒定律,(b)中反應物的總能量應該________其生成物的總能量.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據事實寫出下列反應的熱化學方程式.
(1)1g碳與適量水蒸氣反應生成CO和H2 , 需要吸收10.94KJ熱量,此反應的熱化學方程式為
(2)已知2.0g燃料肼(N2H4)氣體完全燃燒生成N2和水蒸氣時,放出33.4KJ的熱量,則肼燃燒的熱化學方程式為
(3)2molAl(s)與適量O2(g)反應生成Al2O3(s),放出1669.8KJ的熱量.此反應的熱化學方程式為
(4)2.3g某液態有機物和一定量的氧氣混合點燃,恰好完全燃燒,生成2.7g液態水和2.24LCO2(標準狀況)并放出68.35KJ的熱量.寫出此反應的熱化學方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著科學技術的不斷進步,研究物質的手段和途徑越來越多,H3、O4、C60、N5+等已被發現.下列有關說法中,正確的是( )
A.H2與H3屬于同素異形體
B.O2與O4屬于同位素
C.C60的質量數為720g/mol
D.N5+中含有36個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是現行中學化學教科書中元素周期表的一部分,表中的每個編號表示一種元素,請根據要求回答問題:
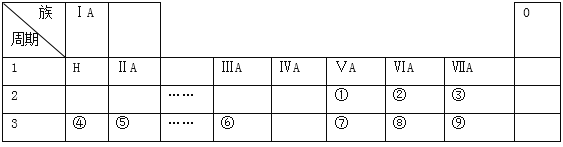
(l)②表示的元素是 ______ (填元素符號).
(2)②③④⑤⑧和⑨這六種元素的簡單離子半徑由小到大排序為:__________(用離子符號表示);上表所示元素中,非金屬性最強的是 ______ (填元素符號);⑦⑧⑨這三種元素的最高價氧化物對應的水化物的酸性由強到弱的順序為:_______________(填分子式)
(3)元素⑨的單質可以用來制取漂白粉,漂白粉的有效成分是 ______ (填化學式);用電子式表示元素⑤與⑨形成化合物的過程 ______ .
(4)上述元素中,單質能與水劇烈反應且水作還原劑,此單質是_________(填化學式)
(5)寫出元素④的最高價氧化物對應的水化物與元素⑥的最高價氧化物相互反應的化學方程式 ______ .
(6)某同學為了比較元素⑧和⑨非金屬性的相對強弱,用如圖所示裝置進行實驗:
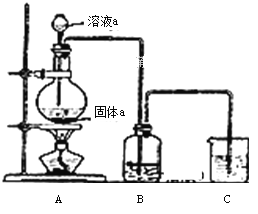
① 裝置B中溶液的溶質為______(寫化學式).
② 裝置C中盛放燒堿稀溶液,目的是______.反應的離子方程式是______
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com