
【題目】某校化學興趣小組模擬利用氨氣和次氯酸鈉合成肼(N2H4)的過程。設計了如圖裝置:

(1)盛放濃鹽酸的儀器名稱是_______________。
(2)裝置⑤中發生反應的化學方程式為____________________________________。
(3)在________(填圖中的裝置數字序號)裝置中制備肼,發生反應的化學方程式為______________________________________________。
(4)②中盛裝的試劑為_______________,作用是________________。
(5)肼是一種可燃性氣體,可用作火箭燃料,與氧氣或氮的氧化物反應時,生成物均無污染,寫出肼和一氧化氮燃燒反應的化學方程式_____________________________ 。
【答案】分液漏斗 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ③ 2NH3+NaClO=N2H4+NaCl+H2O NaOH溶液 吸收多余的Cl2 N2H4+2NO
CaCl2+2NH3↑+2H2O ③ 2NH3+NaClO=N2H4+NaCl+H2O NaOH溶液 吸收多余的Cl2 N2H4+2NO![]() 2N2+2H2O
2N2+2H2O
【解析】
由圖可知,①中發生的反應為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,打開K1,Cl2能和NaOH溶液反應生成NaCl、NaClO,⑤用來制取氨氣,④裝置是安全瓶,能防倒吸,在③中氨氣和NaClO反應生成N2H4,發生反應:ClO-+2NH3=N2H4+Cl-+H2O,最后關閉K1,②中裝有NaOH溶液,用于吸收多余的Cl2,根據以上分析解答此題。
MnCl2+Cl2↑+2H2O,打開K1,Cl2能和NaOH溶液反應生成NaCl、NaClO,⑤用來制取氨氣,④裝置是安全瓶,能防倒吸,在③中氨氣和NaClO反應生成N2H4,發生反應:ClO-+2NH3=N2H4+Cl-+H2O,最后關閉K1,②中裝有NaOH溶液,用于吸收多余的Cl2,根據以上分析解答此題。
由圖可知,①中發生的反應為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,打開K1,Cl2能和NaOH溶液反應生成NaCl、NaClO,⑤用來制取氨氣,④裝置是安全瓶,能防倒吸,在③中氨氣和NaClO反應生成N2H4,發生反應:ClO-+2NH3=N2H4+Cl-+H2O,最后關閉K1,②中裝有NaOH溶液,用于吸收多余的Cl2 ;
MnCl2+Cl2↑+2H2O,打開K1,Cl2能和NaOH溶液反應生成NaCl、NaClO,⑤用來制取氨氣,④裝置是安全瓶,能防倒吸,在③中氨氣和NaClO反應生成N2H4,發生反應:ClO-+2NH3=N2H4+Cl-+H2O,最后關閉K1,②中裝有NaOH溶液,用于吸收多余的Cl2 ;
(1)①為實驗室制取氯氣的裝置,盛放濃鹽酸的儀器為分液漏斗;
答案為:分液漏斗。
(2) ⑤用來制取氨氣,化學方程式為:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
答案為:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3) 在③中氨氣和NaClO反應生成N2H4,發生反應:2NH3+NaClO=N2H4+NaCl+H2O ;
答案為:③;2NH3+NaClO=N2H4+NaCl+H2O 。
(4) ②中裝有NaOH溶液,用于吸收多余的Cl2;
答案為:NaOH溶液;吸收多余的Cl2 。
(5) 肼與氧氣或氮的氧化物反應時,生成物無污染,所以氮元素反應后生成氮氣、氫元素生成水無污染,肼和一氧化氮反應的化學方程式為:N2H4+2NO![]() 2N2+2H2O;
2N2+2H2O;
答案為:N2H4+2NO![]() 2N2+2H2O。
2N2+2H2O。


 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】按要求回答下列有關有機化學的問題:
(1)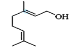 的分子式為__。
的分子式為__。
(2)苯與濃硫酸和濃硝酸混合加熱產生硝基苯的反應方程式為__。
(3)某有機物的結構簡式如圖所示,根據結構簡式回答下列問題:
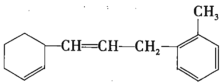
①1mol該物質和足量溴水混合,消耗Br2的物質的量為__mol。
②該物質苯環上的一氯代物有__種。
③下列說法不正確的是__(填序號)。
a.該有機物可發生加成、取代、氧化等反應
b.該有機物和苯屬于同系物
c.該有機物使溴水褪色的原理與乙烯相同
d.該有機物能使酸性KMnO4溶液褪色,發生的是加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖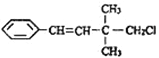 ,關于該有機物的下列敘述中不正確的是( )
,關于該有機物的下列敘述中不正確的是( )
A. 一定條件下,能發生加聚反應
B. 1mol該有機物在一定條件下最多能與4molH2發生反應
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 該有機物苯環上的一溴代物有3種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀可用于生活消毒,是中學化學常見的氧化劑。工業上,用軟錳礦(主要成分是二氧化錳)制高錳酸鉀的流程如下(部分條件和產物省略):
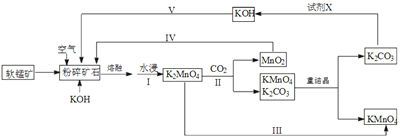
請回答下列問題:
(1)提高錳酸鉀浸出率(浸出錳酸鉀質量與固體總質量之比)的措施有______________________。
(2)寫出向二氧化錳和氫氧化鉀熔融物中通入空氣時發生的主要化學反應的方程式:___________________________________。
(3)從經濟性考慮試劑X宜選擇(填名稱):___________。上述流程中,設計步驟IV和V的目的是____________________________________。
(4)以惰性材料為電極,采用電解錳酸鉀溶液的方法完成步驟III轉化。
①陽極反應式為___________________。
②電解過程中,陰極附近電解質溶液的pH將_______(填:增大、減小或不變)。
(5)測定高錳酸鉀樣品純度:向高錳酸鉀溶液中滴定硫酸錳溶液,產生黑色沉淀。當溶液由紫紅色剛好褪色且半分鐘不變色時,達到滴定終點。寫出離子方程式:__________________。
(6)已知:常溫下,Ksp [Mn(OH)2]=2.010-13。工業上,調節pH沉淀廢水中Mn2+。當pH=10時,溶液中c(Mn2+)=______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列物質:① N2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl。
(1)只由非極性鍵構成的物質是__________________(填編號)。
(2)由離子鍵和極性鍵構成的物質是_______________。
(3)⑤H2O2的電子式為:_________________。
(4)用電子式表示⑥MgF2的形成過程:______________。
(5)下列說法不正確的是________。
①共價化合物中含共價鍵,也可能含離子鍵
②因為H2CO3酸性<H2SO3酸性,所以非金屬性C<S
③含金屬元素的化合物不一定是離子化合物
④由非金屬元素組成的化合物一定是共價化合物
⑤熔融狀態能導電的物質是離子化合物
⑥由分子組成的化合物中一定存在共價鍵
A. ①③⑤ B. ①②⑥ C. ①②④⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向容積為2L的密閉容器中充入一定量的SO2和O2,發生反應2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段時間后達平衡,反應過程中測定的部分數據見下表:
2SO3(g) H=-196kJ·moL1,一段時間后達平衡,反應過程中測定的部分數據見下表:
反應時間/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列說法不正確的是
A. 反應在前5min的平均速率為v (SO2)=0.08mol·L1·min1
B. 保持溫度不變,向平衡后的容器中再充入1molSO2和0.5molO2時,v (正)> v (逆)
C. 該溫度,反應的平衡常數為11.25L·mol-1
D. 相同溫度下,起始時向容器中充入1.5mol SO3,達平衡時SO3的轉化率為40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有機物A、B、C、D、E、F有以下轉化關系。A的產量可以衡量一個國家的石油化工發展水平;E是不溶于水且具有香味的無色液體,相對分子質量是C的2倍;F為高分子化合物。結合如圖關系回答問題:
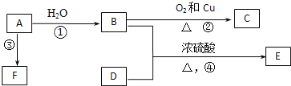
(1)寫出C的結構簡式:___________
(2)寫出B、D中官能團的名稱:B____________,D_____________.
(3)寫出下列反應的化學方程式:
②____________
④____________
(4)有機化合物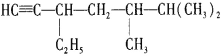 的名稱是____________,將其在催化劑存在下完全與H2加成,所得烷烴的名稱是___________
的名稱是____________,將其在催化劑存在下完全與H2加成,所得烷烴的名稱是___________
(5)相對分子質量為72且沸點最低的烷烴的結構簡式為________
(6)乙醇的分子結構為: ,分子內脫水生成乙烯時,斷開的鍵是______(填編號。下同);在銅催化作用下發生催化氧化反應時,斷開的鍵是____;酯化反應時,斷開的鍵是______
,分子內脫水生成乙烯時,斷開的鍵是______(填編號。下同);在銅催化作用下發生催化氧化反應時,斷開的鍵是____;酯化反應時,斷開的鍵是______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機物中,在不同條件下,既能發生水解反應和消去反應,又能發生酯化反應并能與金屬鈉反應放出氫氣的是 ( )
①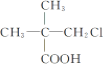 ②
②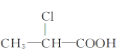 ③
③![]() ④
④
A. ②B. ②③C. ①②D. ①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為探究SO2的性質,按下圖所示裝置進行實驗。
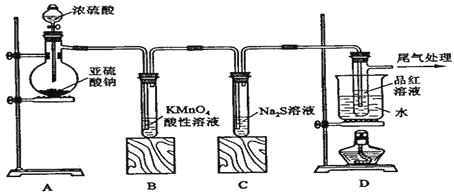
請到答F列問題:
(1)裝置A中盛放亞硫酸鈉的儀器名稱是 ,其中發生反應的化學方程式為 ;
(2)實驗過程中,裝置B、C中發生的現象分別是 、 ,這些現象分別說明SO2具有的性質是 和 ;裝置B中發生反應的離子方程式為 ;
(3)裝置D的目的是探究SO2與品紅作用的可逆性,請寫出實驗操作及現象 ;
(4)尾氣可采用 溶液吸收。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com