
 從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式. 2H2↑+O2↑;根據電解水的實驗“正氧負氫”(也可從反應現象),可知與電源負極相連的試管內產生的氣體是H2;
2H2↑+O2↑;根據電解水的實驗“正氧負氫”(也可從反應現象),可知與電源負極相連的試管內產生的氣體是H2; 2H2↑+O2↑; 氫氣(H2);(2)分子的種類;原子的種類、數目;(3)構成分子的原子種類,構成分子的原子個數;
2H2↑+O2↑; 氫氣(H2);(2)分子的種類;原子的種類、數目;(3)構成分子的原子種類,構成分子的原子個數;

 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:初中化學 來源: 題型:
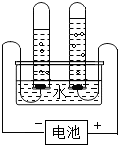
 從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.圖為某同學進行電解水實驗的裝置圖,據此回答:
從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.圖為某同學進行電解水實驗的裝置圖,據此回答:
查看答案和解析>>
科目:初中化學 來源: 題型:
 (2012?延慶縣一模)從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
(2012?延慶縣一模)從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
 (2010?石景山區二模)從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
(2010?石景山區二模)從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.
從宏觀與微觀兩個角度認識物質及其運動的特殊視角是化學不同于其他科學最特征的思維方式.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com