小華想測定Cu-Ag合金和Cu-Zn合金中的Cu的質量分數,實驗室只提供一瓶未標明質量分數的稀鹽酸和必要的儀器.
(1)你認為能測出其中的Cu的質量分數的是合金.
(2)小華取該合金32.5克與足量這種鹽酸充分反應,經測定,產生了0.4克氣體.該合金中的Cu的質量分數是.
(3)想測定鹽酸的質量分數,你認為實驗時必須提供和測出的數據(填編號)
A.參加反應的合金質量 B.參加反應的稀鹽酸的質量
C.參加反應的稀鹽酸的體積和密度 D.產生的氣體的質量.
【答案】
分析:在金屬活動性順序中,氫前的金屬能與酸發生置換反應生成氫氣,根據生成氫氣的質量,可以求得合金中鋅的質量,從而求得銅的質量和銅的含量,要求鹽酸的溶質的質量分數,需知道鹽酸中溶質的質量和所用鹽酸溶液的質量.
解答:解:(1)只給出鹽酸和必要的儀器,則合金中需含有能與鹽酸反應的金屬,鋅排在氫的前面,而銅和銀排在氫的后面,所以本題答案為:Cu~Zn;
(2)設生成0.4g氫氣需要鋅的質量為x,則有
Zn+2HCl═ZnCl
2+H
2↑
65 2
x 0.4g
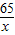
=
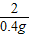
x=13g
該合金中的Cu的質量分數是
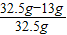
×100%=60%
(3)要求鹽酸的溶質的質量分數,需知道溶質的質量和溶液的質量,知道所用的鹽酸的體積和鹽酸的密度,能求出鹽酸的質量,而溶質的質量可以通過氫氣的質量求出,所以本題答案為:BD或CD.
點評:本題考查了金屬的性質以及根據化學方程式進行的計算,完成此題,可以依據已有的知識進行.

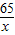 =
=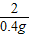
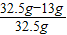 ×100%=60%
×100%=60%

 名校課堂系列答案
名校課堂系列答案