
鋼鐵的生產(chǎn)和使用是人類文明和社會進步的一個重要標志。
(1)每年鋼鐵銹蝕都會造成巨大的損失,鐵制品銹蝕的主要原因是__________
___________________________________________________________________。
 (2)校課外興趣小組的同學們?nèi)H坊某鋼鐵廠生鐵樣品進行實驗:將四份不同質(zhì)量
(2)校課外興趣小組的同學們?nèi)H坊某鋼鐵廠生鐵樣品進行實驗:將四份不同質(zhì)量 的生鐵樣品(假定其中
的生鐵樣品(假定其中 只含單質(zhì)鐵和單質(zhì)碳)分別加到100 g質(zhì)量分數(shù)相同的稀硫酸中,充分反應后,測得的實驗數(shù)據(jù)如下表(已知:在標準狀況下,22.4 L H2的質(zhì)量為2 g)
只含單質(zhì)鐵和單質(zhì)碳)分別加到100 g質(zhì)量分數(shù)相同的稀硫酸中,充分反應后,測得的實驗數(shù)據(jù)如下表(已知:在標準狀況下,22.4 L H2的質(zhì)量為2 g)
| 實驗序號 | 1 | 2 | 3 | 4 |
| 生鐵樣品的質(zhì)量/g | 2.88 | 5.76 | 9.24 | 10.28 |
| 生成H2的體積 (標準狀況下)/L | 1.12 | 2.24 | 3.36 | m |
通過計算回答下列問題:
①上述表格中m的值為_______________________________________________。
②根據(jù)表中數(shù)據(jù)計算稀硫酸中H2SO4的質(zhì)量分數(shù)。
【解析】(1)鐵生銹是鐵與空氣中的氧氣和水蒸氣共同作用的結(jié)果。(2)分析表中數(shù)據(jù)可知,當生鐵和硫酸充分反應時每增加2.88 g生鐵,就會產(chǎn)生1.12 L氫氣,因此當生鐵的質(zhì)量為8.64 g時,就會產(chǎn)生3.36 L氫氣,由表中數(shù)據(jù)可知第三次加入9.24 g生鐵,產(chǎn)生了3.36 L氫氣,說明此時硫酸已用完,生鐵有剩余,因此第四次產(chǎn)生氫氣的體積仍為3.36 L,根據(jù)100 g稀硫酸最多產(chǎn)生3.36 L氫氣,可求出稀硫酸中H2SO4的質(zhì)量分數(shù)。
答 案:(1)鐵與空氣中的氧氣和水蒸氣發(fā)生反應
案:(1)鐵與空氣中的氧氣和水蒸氣發(fā)生反應
(2)①3.36
②解:據(jù)實驗3進行計算
生成H2的質(zhì)量為: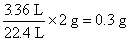
設稀硫酸中H2SO4的質(zhì)量為x。
Fe + H2SO4====FeSO4 + H2↑
98 2
x 0.3 g
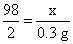
x=14.7 g
稀硫酸中H2SO4的質(zhì)量分數(shù)為:

答:略


科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源: 題型:

| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
科目:初中化學 來源: 題型:

| 1 | 5 |
查看答案和解析>>
科目:初中化學 來源: 題型:

| ||
| ||
| 1 |
| 5 |
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com