
 x=32.5g
x=32.5g  y=49g
y=49g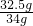 ×100%=95.6%.
×100%=95.6%. ×100%=24.5%.
×100%=24.5%.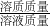 ×100%”即可求出原硫酸的質量百分比濃度.
×100%”即可求出原硫酸的質量百分比濃度.

 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:初中化學 來源: 題型:
有不純的鋅34克與200克硫酸溶液恰好完全反應,放出1克氫氣.計算
(1)鋅的純度;(保留一位小數)
(2)原硫酸的質量百分比濃度.(保留一位小數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com