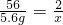請用“>”、“<”、“=”或“無法比較”填空.
(1)pH________ 7的溶液能使紫色石蕊試液變紅.石灰水的pH________7.
(2)相對分子質量________ 29的氣體可用向上排空氣法收集.
(3)5.6g含銅的鐵粉與足量的稀硫酸反應,生成的氫氣質量________0.2g.
(4)一個NH4+離子和一個CH4分子相比,所含質子數(shù)前者________后者,所含電子數(shù)前者________后者.
(5)Xg Cu經過下列一系列變化Cu→CuO→CuSO4→Cu(OH)2→CuCl2→Cu
(設各步反應中各物質均無損耗),最后生成的Cu的質量________Xg;
(6)在室溫時,某同學配制100g溶質質量分數(shù)為11.5%的KNO3溶液,計算后,他在天平左盤放入10g砝碼,游碼定位于1.5g處,他在右盤中放入KNO3晶體,稱量完畢后,他將100mL量筒平放在桌上,視線與量筒內凹液面的最低處保持水平,量取了88.5mL水,用以配制溶液.
請問該同學這樣配出的溶液的溶質質量分數(shù)________11.5%.
解:(1)能使紫色石蕊試液變紅的溶液呈酸性,pH小于7,石灰水的pH大于7,故填:<,>;
(2)相對分子質量大于29的可以使用向上排空氣法收集,故填:>;
(3)設5.6g純鐵生成氫氣的質量為x
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
5.6g x
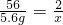
x=0.2g,
5.6g含銅的鐵粉與足量的稀硫酸反應,銅不能生成氫氣,故生成氫氣的質量小于0.2g,
故填:<;
(4)一個NH
4+離子質子數(shù)是7+1×4=11,電子數(shù)是11-1=10,一個CH
4分子質子數(shù)是6+1×4=10,電子數(shù)是10,故填:>,=;
(5)化學反應前后銅元素的質量不變,所以最后生成的銅的質量為Xg,故填:=;
(6)配制100g溶質質量分數(shù)為11.5%的KNO
3溶液,需要硝酸鉀的質量為:100g×11.5%=11.5g,稱量時游碼放在1.5g處,右盤放藥品,實際稱得的硝酸鉀的質量為10g-1.5g=8.5g,溶質質量減小,溶液變稀,溶質質量分數(shù)減小,故填:<.
分析:根據(jù)已有的知識進行分析,酸性溶液的pH小于7,堿性溶液的pH大于7;空氣的平均相對分子質量為29,相對分子質量大于29的可以使用向上排空氣法收集;根據(jù)鐵與稀硫酸反應的質量關系可以求得生成氫氣的質量;質子數(shù)就是離子中各原子的質子數(shù)之和;化學反應前后元素的質量不變;稱量時要左物右碼.
點評:本題考查了溶液的酸堿性與pH的關系以及溶液的配制等知識,完成此題,可以依據(jù)已有的知識結合題干提供的信息進行.要求同學們加強對基礎知識的儲備,以便靈活應用.