
【題目】三位分別來自法國、美國、荷蘭的科學家因研究“分子機器的設計與合成”而獲得2016年諾貝爾化學獎。納米分子機器日益受到關注,機器的“車輪”常用組件如圖。下列說法不正確的是( )
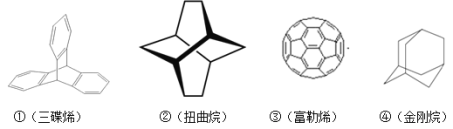
A.①③均能發生加成反應
B.②④互為同分異構體
C.①②③④均屬于烴
D.①②④的一氯代物分別為3種、3種、2種
科目:高中化學 來源: 題型:
【題目】某小組進行如圖實驗。欲使溶液紅色加深,下列操作或分析正確的是

A.加入少量KCl固體
B.再滴加5~6滴1 mol/L KSCN溶液
C.再滴加3~5滴0.01 mol/L NaOH溶液
D.對溶液降溫,也可觀察到溶液紅色加深,說明反應為:FeCl3+3KSCN![]() Fe(SCN)3+3KCl△H>0
Fe(SCN)3+3KCl△H>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】著名化學家徐光憲在稀土化學等領域取得了卓越成就,被譽為“稀土界的袁隆平”。稀土元素包括鈧、釔和鑭系元素。請回答下列問題:
(1)寫出基態二價鈧離子(Sc2+)的核外電子排布式____,其中電子占據的軌道數為 ____。
(2)在用重量法測定鑭系元素和使鑭系元素分離時,總是使之先轉換成草酸鹽,然后經過灼燒而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3nH2O+6HCl。
①H2C2O4中碳原子的雜化軌道類型為____;1 mol H2C2O4分子中含σ鍵和π鍵的數目之比為 ___。
②H2O的VSEPR模型為 ___;寫出與H2O互為等電子體的一種陰離子的化學式_______。
③HCI和H2O可以形成相對穩定的水合氫離子鹽晶體,如HCl2H2O,HCl2H2O中含有H5O2+,結構為![]() ,在該離子中,存在的作用力有___________
,在該離子中,存在的作用力有___________
a.配位鍵 b.極性鍵 c.非極性鍵 d.離子鍵 e.金屬鍵 f氫鍵 g.范德華力 h.π鍵 i.σ鍵
(3)表中列出了核電荷數為21~25的元素的最高正化合價:
元素名稱 | 鈧 | 鈦 | 釩 | 鉻 | 錳 |
元素符號 | Sc | Ti | V | Cr | Mn |
核電荷數 | 21 | 22 | 23 | 24 | 25 |
最高正價 | +3 | +4 | +5 | +6 | +7 |
對比上述五種元素原子的核外電子排布與元素的最高正化合價,你發現的規律是___________
(4)PrO2(二氧化鐠)的晶胞結構與CaF2相似,晶胞中Pr(鐠)原子位于面心和頂點。假設相距最近的Pr原子與O原子之間的距離為a pm,則該晶體的密度為_____gcm-3(用NA表示阿伏加德羅常數的值,不必計算出結果)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S和Cl元素的單質及化合物在工業生產中的有效利用備受關注。請回答下列問題:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代數式表示)。
(2)25℃時,H2SO3溶液中各含硫微粒的物質的量分數(δ)與溶液pH的變化關系如圖所示。

已知25℃時,NaHSO3的水溶液pH<7,用圖中的數據通過計算解釋原因 ____________________。
(3)利用“ Na-CO2”電池將CO2變廢為寶。我國科研人員研制出的可充電“ Na-CO2”電池,以鈉箔和多壁碳納米管(MWCNT)為電極材料,總反應為4Na+3CO2![]() 2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖所示:
2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖所示:

①放電時,正極的電極反應式為______。
②選用高氯酸鈉—四甘醇二甲醚做電解液的優點是_______(至少寫兩點)。
(4)氯氨是氯氣遇到氨氣反應生成的一類化合物,是常用的飲用水二級消毒劑,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副產物少于其它水消毒劑。
①一氯胺(NH2Cl)的電子式為_______。一氯胺是重要的水消毒劑,其原因是由于一氯胺在中性、酸性環境中會發生水解,生成具有強烈殺菌作用的物質,該反應的化學方程式為_______。
②在恒溫條件下,2molCl2和1molNH3發生反應2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),測得平衡時Cl2和HCl的物質的量濃度與平衡總壓的關系如圖所示:
NHCl2(l)+2HCl(g),測得平衡時Cl2和HCl的物質的量濃度與平衡總壓的關系如圖所示:

計算C點時該反應的壓強平衡常數Kp(C)= _______ (Kp是平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高氯酸在化工生產中有廣泛應用,工業上以NaClO4為原料制備高氯酸的原理如圖所示.下列說法正確的是
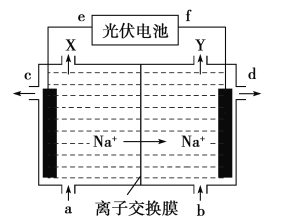
A. 上述裝置中,f極為光伏電池的正極
B. 陰極的電極反應為2H2O-4e- =4H++O2↑
C. d處得到較濃的NaOH 溶液,c處得到HClO4
D. 若轉移2mol電子,理論上生成100.5gHClO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫常壓下電解法合成氨的原理如圖所示。下列說法中錯誤的是( )
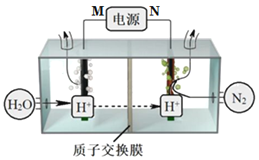
A.M為外接電源的正極
B.右室電極反應式為N2+6H++6e-=2NH3
C.理論上左、右室產生的氣體同溫同壓下體積比為3︰4
D.該合成氨反應是化合反應、放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取乙烯的發生裝置如圖所示。下列說法正確的是

A.燒瓶中加入乙醇、濃硫酸和碎瓷片
B.反應溫度控制在140℃
C.導出的氣體中只有乙烯
D.可用向上排氣法收集乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“太陽水”電池裝置如圖所示,該電池由三個電極組成,其中a為TiO2電極,b為Pt電極,c為WO3電極,電解質溶液為pH=3的Li2SO4-H2SO4溶液。鋰離子交換膜將電池分為A、B兩個區,A區與大 氣相通,B區為封閉體系并有N2保護。下列關于該電池的說法錯誤的是( )
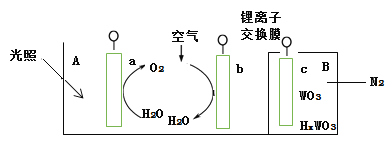
A.若用導線連接a、c,則a為負極,該電極附近pH減小
B.若用導線連接a、c,則c電極的電極反應式為HxWO3 - xe- =WO3 + xH+
C.若用導線先連接a、c,再連接b、c,可實現太陽能向電能轉化
D.若用導線連接b、c, b電極的電極反應式為O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸亞乙酯是一種重要的添加劑,其結構簡式為![]() 。用環氧乙烷合成碳酸亞乙酯的反應為:
。用環氧乙烷合成碳酸亞乙酯的反應為:![]() +CO2
+CO2![]() 。下列說法錯誤的是( )
。下列說法錯誤的是( )
A.上述反應屬于加成反應
B.碳酸亞乙酯的所有二氯代物中均存在手性碳原子
C.碳酸亞乙酯中的所有氧原子處于同一平面內
D.1mol碳酸亞乙酯最多可消耗2molNaOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com