
【題目】一定量的![]() 在恒壓密閉容器中發生反應:
在恒壓密閉容器中發生反應:![]() 。平衡時,體系中各氣體體積分數與溫度的關系如圖所示:
。平衡時,體系中各氣體體積分數與溫度的關系如圖所示:

(1).已知甲烷、碳、氫氣的燃燒熱分別為![]() 、
、![]() 、
、![]() ,則該反應的反應熱
,則該反應的反應熱![]() __________。
__________。
(2).下列能說明反應一定達到平衡狀態的是_______。
![]() 和
和![]() 的體積分數相等
的體積分數相等
![]() 混合氣體的平均相對分子質量不變
混合氣體的平均相對分子質量不變
![]() 混合氣體的密度不變
混合氣體的密度不變
![]() 氣體總壓強不再變化
氣體總壓強不再變化
![]() 碳的質量不再改變
碳的質量不再改變
(3).![]() 時,若在平衡體系中充入惰性氣體,此時反應速率____
時,若在平衡體系中充入惰性氣體,此時反應速率____![]() 填“變大”、“變小”或“不變”
填“變大”、“變小”或“不變”![]() ,且
,且![]() _____
_____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
(4).![]() 時,若在平衡體系中充入等體積的
時,若在平衡體系中充入等體積的![]() 和
和![]() ,則平衡_____移動,其理由是_______。
,則平衡_____移動,其理由是_______。
(5).![]() 時,反應達平衡后
時,反應達平衡后![]() 的轉化率為____________。
的轉化率為____________。
【答案】![]()
![]() 變小
變小 ![]() 不移動
不移動 ![]() 、
、![]() 的濃度不變
的濃度不變 ![]()
【解析】
本題考查反應熱的計算,化學平衡移動,化學平衡狀態的判斷,難度中等。
(1).已知甲烷、碳、氫氣的燃燒熱分別為![]() 、
、![]() 、
、![]() ,則有
,則有
![]() ;
;![]()
![]() ;
;
根據蓋斯定律![]() 得到目標方程式;
得到目標方程式;
(2).![]() ,根據化學平衡的直接和間接判斷依據判斷;
,根據化學平衡的直接和間接判斷依據判斷;
(3).恒溫恒壓充惰性氣體,相當于反應物濃度減小,速率減小,平衡正向移動;
(4).![]() 時,若在平衡體系中充入等體積的
時,若在平衡體系中充入等體積的![]() 和
和![]() ,則平衡不移動,因為
,則平衡不移動,因為![]() 、
、![]() 的濃度不變;
的濃度不變;
(5).![]() 時,氫氣的體積分數為百分之四十,用三段式計算反應達平衡后
時,氫氣的體積分數為百分之四十,用三段式計算反應達平衡后![]() 的轉化率;
的轉化率;
![]() 已知甲烷、碳、氫氣的燃燒熱分別為
已知甲烷、碳、氫氣的燃燒熱分別為![]() 、
、![]() 、
、![]() ,則有
,則有
![]() ;
;![]()
![]() ;
;
根據蓋斯定律![]() 得:
得:![]()
![]() ,則該反應的反應熱
,則該反應的反應熱![]() ;
;
故答案為:![]() ;
;
![]() 和
和![]() 的體積分數相等,不能說明反應一定達到平衡狀態,故a錯誤;
的體積分數相等,不能說明反應一定達到平衡狀態,故a錯誤;
![]() 由于碳為固體,且反應前后氣體分子數不相等,因此混合氣體的平均相對分子質量不變,能說明反應一定達到平衡狀態,故b正確;
由于碳為固體,且反應前后氣體分子數不相等,因此混合氣體的平均相對分子質量不變,能說明反應一定達到平衡狀態,故b正確;
![]() 由于碳為固體,所以混合氣體的密度不變,能說明反應一定達到平衡狀態,故c正確;
由于碳為固體,所以混合氣體的密度不變,能說明反應一定達到平衡狀態,故c正確;
![]() 因為反應在恒壓條件下進行,所以氣體總壓強不再變化,不能說明反應一定達到平衡狀態,故d錯誤;
因為反應在恒壓條件下進行,所以氣體總壓強不再變化,不能說明反應一定達到平衡狀態,故d錯誤;
![]() 碳的質量不再改變,能說明反應一定達到平衡狀態,故e正確;
碳的質量不再改變,能說明反應一定達到平衡狀態,故e正確;
故答案為:bce;
![]() 時,因為反應在恒壓條件下進行,若在平衡體系中充入惰性氣體,體積增大反應物濃度減小,所以反應速率變小;平衡正向移動,則
時,因為反應在恒壓條件下進行,若在平衡體系中充入惰性氣體,體積增大反應物濃度減小,所以反應速率變小;平衡正向移動,則![]() ;
;
故答案為:變小;![]() ;
;
![]() 時,若在平衡體系中充入等體積的
時,若在平衡體系中充入等體積的![]() 和
和![]() ,則平衡不移動,因為
,則平衡不移動,因為![]() 、
、![]() 的濃度不變;
的濃度不變;
故答案為:不移動;![]() 、
、![]() 的濃度不變;
的濃度不變;
![]()
![]()
開始(mol)
轉化(mol) x 2x
平衡(mol) ![]() 2x
2x
則![]() ,解得
,解得![]() ,所以
,所以![]() 時,反應達平衡后
時,反應達平衡后![]() 的轉化率為
的轉化率為![]() ;
;
故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】已知甲為恒壓容器、乙為恒容容器。相同條件下充入等物質的量NO2氣體,且起始時體積相同。發生反應:2NO2(g) ![]() N2O4(g) ΔH<0一段時間后相繼達到平衡狀態。下列說法中正確的是( )
N2O4(g) ΔH<0一段時間后相繼達到平衡狀態。下列說法中正確的是( )

A.平衡時NO2體積分數:甲<乙
B.乙比甲先達到平衡狀態
C.該反應的平衡常數表達式![]()
D.NO2的平衡轉化率:甲<乙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨硼烷(NH3·BH3)電池可在常溫下工作,裝置如圖所示。未加入氨硼烷之前,兩極室質量相等,電池反應為NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列說法正確的是( )

A. 正極的電極反應式為2H++2e-===H2↑
B. 電池工作時,H+通過質子交換膜向負極移動
C. 電池工作時,正、負極分別放出H2和NH3
D. 工作足夠長時間后,若左右兩極室質量差為1.9 g,則電路中轉移0.6 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.反應2CO(g)+O2(g)=2CO2(g)在一定條件下能自發進行的原因是ΔS>0
B.由Ksp[Mg(OH)2]=1.8×10-11可知常溫下pH=8的溶液中,c(Mg2+)≤1.8×10-5mol·L1
C.反應H2(g)+Cl2(g)=2HCl(g)的ΔH可用下式換算:ΔH=反應中斷裂的舊化學鍵鍵能之和-反應中形成的新化學鍵鍵能之和
D.由反應C(s)+1/2O2 (g)=CO(g)ΔH=-111 kJ·mol1可知C的燃燒熱是111 kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于說法正確的是( )
A. HCl和NaOH反應的中和熱△H=﹣57.3 kJ/mol。則H2SO4和Ba(OH)2反應的中和熱△H=2×(﹣57.3) kJ/mol
B. 已知C2H5OH(l)的燃燒熱是1366.8 kJ/mol,則C2H5OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) 反應的△H=-1366.8 kJ/mol
C. 一定條件下2SO2(g)+O2(g)![]() 2SO3(g) △H1<0,2SO2(g)+O2(g)
2SO3(g) △H1<0,2SO2(g)+O2(g)![]() 2SO3(l) △H2<0,則△H1>△H2
2SO3(l) △H2<0,則△H1>△H2
D. 在一定溫度和壓強下,將0.5mol N2和1.5 mol H2置于密閉容器中充分反應生成NH3(g),放出熱量19.3 kJ,則其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2NO2(g)![]() 2NO(g)+O2(g)在密閉容器中反應,達到平衡狀態的標志是( )
2NO(g)+O2(g)在密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n mol O2的同時生成2n mol NO2
②單位時間內生成n mol O2的同時,生成2n mol NO
③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2:2:1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變的狀態
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,用
時,用![]() 二元弱酸
二元弱酸![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲線如圖。下列說法不正確的是
溶液所得滴定曲線如圖。下列說法不正確的是![]()
![]()

A.點![]() 所示溶液中:
所示溶液中:![]()
B.點![]() 所示溶液中:
所示溶液中:![]()
C.點![]() 所示溶液中:
所示溶液中:![]()
D.滴定過程中可能出現:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉![]() 用于漂白織物、纖維、紙漿,具有對纖維損傷小的特點.其在溶液中可生成
用于漂白織物、纖維、紙漿,具有對纖維損傷小的特點.其在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用.已知
都具有漂白作用.已知![]() ,經測定
,經測定![]() 時各組分含量隨pOH變化情況如圖所示
時各組分含量隨pOH變化情況如圖所示![]() 沒有畫出
沒有畫出![]() ,此溫度下,下列分析正確的是
,此溫度下,下列分析正確的是![]()
![]()

A.![]() 的電離平衡常數的數值
的電離平衡常數的數值![]()
B.亞氯酸鈉在酸性條件下較穩定
C.![]() 時,溶液中含氯微粒的濃度大小為:
時,溶液中含氯微粒的濃度大小為:![]()
D.同濃度的![]() 溶液和
溶液和![]() 溶液等體積混合,則混合溶液中有
溶液等體積混合,則混合溶液中有![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙三個容器中最初存在的物質及其數量如圖所示,三個容器最初的容積相等、溫度相同,反應中甲、丙的容積不變,乙中的壓強不變,在一定溫度下反應達到平衡。下列說法正確的是
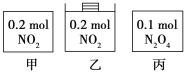
A.平衡時各容器內c(NO2)的大小順序為乙>甲>丙
B.平衡時N2O4的百分含量:乙>甲=丙
C.平衡時甲中NO2與丙中N2O4的轉化率不可能相同
D.平衡時混合物的平均相對分子質量:甲>乙>丙
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com