
【題目】前四周期原子序數依次增大的六種元素A、B、C、D、E、F中,A、B屬于同一短周期元素且相鄰,A元素所形成的化合物種類最多,C、D、E、F是位于同一周期的金屬元素,基態C、F原子的價電子層中未成對電子均為1個,且C、F原子的電子數相差為10,基態D、E原子的價電子層中未成對電子數分別為4、2,且原子序數相差為2。
(1)六種元素中第一電離能最小的是_________(填元素符號,下同)。
(2)黃血鹽是由A、B、C、D四種元素形成的配合物C4[D(AB)6],易溶于水,廣泛用作食鹽添加劑(抗結劑)。請寫出黃血鹽的化學式_________,黃血鹽晶體中各種微粒間的作用力不涉及______________(填序號)。
a.金屬鍵 b.共價鍵 c.配位鍵
d.離子鍵 e.氫鍵 f.分子間的作用力
(3)E2+的價層電子排布圖為___________________,很多不飽和有機物在E催化下可與H2發生加成:如①CH2=CH2 ②HC≡CH ③![]() ④HCHO。其中碳原子采取sp2雜化的分子有____________(填物質序號),HCHO分子的立體結構為______________,它加成后產物甲醇的熔、沸點比CH4的熔、沸點高,其主要原因是____________。
④HCHO。其中碳原子采取sp2雜化的分子有____________(填物質序號),HCHO分子的立體結構為______________,它加成后產物甲醇的熔、沸點比CH4的熔、沸點高,其主要原因是____________。
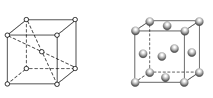
(4)金屬C、F晶體的晶胞如下圖(請先判斷對應的圖),C、F兩種晶體晶胞中金屬原子的配位數之比為_________。金屬F的晶胞中,若設其原子半徑為r,晶胞的邊長為a,根據硬球接觸模型,則r = _______a,列式表示F原子在晶胞中的空間占有率______________(不要求計算結果)。
【答案】K K4Fe(CN)6 aef 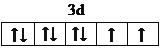 ①③④ 平面三角形 CH3OH分子之間存在氫鍵,熔、沸點比CH4高 2∶3
①③④ 平面三角形 CH3OH分子之間存在氫鍵,熔、沸點比CH4高 2∶3 ![]() a
a ![]() π×100%
π×100%
【解析】
前四周期原子序數依次增大的六種元素A、B、C、D、E、F中,A、B屬于同一短周期元素且相鄰,A元素所形成的化合物種類最多,則A為碳元素、B為N元素;C、D、E、F是位于同一周期的金屬元素,只能處于第四周期,基態C、F原子的價電子層中未成對電子均為1個,且C、F原子的電子數相差為10,可推知C為K、F為Cu,基態D、E原子的價電子層中未成對電子數分別為4、2,且原子序數相差為2,D、E價電子排布分別為3d64s2,3d84s2,故D為Fe、E為Ni,據此分析解答。
根據上述分析,A為C元素,B為N元素,C為K元素,D為Fe元素,E為Ni元素,F為Cu元素。
(1)六種元素中K的金屬性最強,最容易失去電子,其第一電離能最小,故答案為:K;
(2)黃血鹽是由A、B、C、D四種元素形成的配合物C4[D(AB)6],化學式為K4[Fe(CN)6],黃血鹽晶體中含有離子鍵、配位鍵、共價鍵,沒有金屬鍵、氫鍵和分子間作用力,故答案為:K4Fe(CN)6;aef;
(3)鎳為28號元素,Ni2+的價層電子排布式為3d8,故價電子排布圖為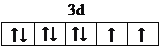 ;①CH2=CH2、③
;①CH2=CH2、③![]() 、④HCHO中C原子價層電子對數都是3,沒有孤電子對,C原子采取sp2雜化;②HC≡CH為C原子價層電子對數是2,沒有孤電子對,C原子采取sp雜化;HCHO分子的立體結構為平面三角形,它的加成產物為甲醇,甲醇分子之間能夠形成氫鍵,其熔、沸點比CH4的熔、沸點高,故答案為:
、④HCHO中C原子價層電子對數都是3,沒有孤電子對,C原子采取sp2雜化;②HC≡CH為C原子價層電子對數是2,沒有孤電子對,C原子采取sp雜化;HCHO分子的立體結構為平面三角形,它的加成產物為甲醇,甲醇分子之間能夠形成氫鍵,其熔、沸點比CH4的熔、沸點高,故答案為: ;①③④;平面三角形; CH3OH分子之間存在氫鍵,熔、沸點比CH4高;
;①③④;平面三角形; CH3OH分子之間存在氫鍵,熔、沸點比CH4高;
(4)金屬K晶體為體心立方堆積,晶胞結構為左圖,晶胞中K原子配位數為8,金屬Cu晶體為面心立方最密堆積,晶胞結構為右圖,以頂點Cu原子研究與之最近的原子位于面心,每個頂點Cu原子為12個面共用,晶胞中Cu原子配位數為12,K、Cu兩種晶體晶胞中金屬原子的配位數之比為 8∶12=2∶3;金屬Cu的晶胞中,根據硬球接觸模型的底面截面圖為![]() ,則Cu原子半徑為r和晶胞邊長a的關系為:4r=
,則Cu原子半徑為r和晶胞邊長a的關系為:4r=![]() a,解得r=
a,解得r=![]() a;Cu原子數目=8×
a;Cu原子數目=8×![]() +6×
+6×![]() =4,4個Cu原子的體積為4×
=4,4個Cu原子的體積為4×![]() πr3=4×
πr3=4×![]() π×(
π×(![]() a)3,晶胞的體積為a3,Cu原子在晶胞中的空間占有率=
a)3,晶胞的體積為a3,Cu原子在晶胞中的空間占有率= =4×
=4×![]() π×(
π×(![]() )3×100%=
)3×100%=![]() π×100%,故答案為:2∶3;
π×100%,故答案為:2∶3;![]() a;
a;![]() π×100%。
π×100%。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列溶液中有關物質的量濃度關系正確的是( )
A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C. 室溫下,由pH=1的CH3COOH溶液與pH=13的NaOH溶液等體積混合,溶液中離子濃度大小的順序為:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 常溫下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列說法正確的是
CH3COOH+OH-,下列說法正確的是
A. 加入少量NaOH固體,c(CH3COO-)減小
B. 加入少量FeCl3固體,c(CH3COO-)減小
C. 稀釋溶液,溶液的pH增大
D. 加入適量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有以下幾種有機物:
①CH4 ②CH3CH2OH ③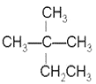 ④癸烷 ⑤CH3COOH ⑥
④癸烷 ⑤CH3COOH ⑥![]() ⑦
⑦![]() ⑧丙烷
⑧丙烷
請利用上述給出的物質按要求回答下列問題:
(1)相對分子質量為44的烷烴的結構簡式為______________;
(2)分子中含有14個氫原子的烷烴的分子式是__________;
(3)用“>”表示①③④⑧熔沸點高低順序:_________________(填序號);
(4)在120℃,1.01×105Pa條件下,某種氣態烴與足量的O2完全反應后,測得反應前后氣體的體積沒有發生改變,則該烴是______(填序號)
(5)有機物⑤和②在一定條件下發生反應的化學方程式是______________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)甲醇![]() 是重要的溶劑和替代燃料,工業上用CO和H2在一定條件下制備
是重要的溶劑和替代燃料,工業上用CO和H2在一定條件下制備![]() 的反應:
的反應:![]() ,在體積為1L的恒容密閉容器中,充2molCO和
,在體積為1L的恒容密閉容器中,充2molCO和![]() ,一定條件下發生上述反應,測得
,一定條件下發生上述反應,測得![]() 和
和![]() 的濃度隨時間變化如圖所示。
的濃度隨時間變化如圖所示。
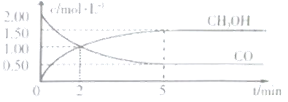
①從反應開始到5min,用一氧化碳表示的平均反應速率υ(CO)=______。
②下列說法正確的是______。
A.達到平衡時,![]() 的轉化率為
的轉化率為![]()
B.5min后容器中混合氣體的平均相對分子質量不再改變
C.達到平衡后,再充入氨氣,反應速率減小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定溫度下,將![]() 與
與![]() 以體積比1:2置于密閉容器中發生反應:
以體積比1:2置于密閉容器中發生反應:
![]() ,達到平衡時
,達到平衡時![]() 的體積分數為
的體積分數為![]() ,該反應的平衡常數
,該反應的平衡常數![]() ______。
______。
(3)碳與水蒸氣反應制取![]() 的相關反應如下:
的相關反應如下:
Ⅰ![]()
Ⅱ![]()
Ⅲ![]()
①計算反應![]() 的
的![]() ______
______![]()
②對于可逆反應![]() ,采取以下措施可以提高
,采取以下措施可以提高![]() 產率的是______。
產率的是______。
A.降低體系的溫度
B.壓縮容器的體積
C.增加CaO的量
D.選用適當的催化劑
(4)以甲醇為燃料,![]() 為氧化劑,KOH溶液為電解質溶液,可制成燃料電池
為氧化劑,KOH溶液為電解質溶液,可制成燃料電池![]() 電極材料為惰性電極
電極材料為惰性電極![]() 。若KOH溶液足量,寫出此燃料電池負極的電極反應式:______;
。若KOH溶液足量,寫出此燃料電池負極的電極反應式:______;
(5)若往20mL![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法正確的是______
溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法正確的是______
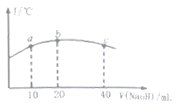
①該燒堿溶液的濃度為![]()
②該燒堿溶液的濃度為![]()
③![]() 的電離平衡常數:b點
的電離平衡常數:b點![]() 點
點
④從b點到c點,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】每天早上5:30起床學習化學會使人變得更加可愛聰明美麗帥氣,而丑陋的人則會被尿憋醒,尿的主要成分是尿素,化學式為CO(NH2)2,結構可表示為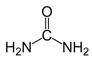 下列有關說法正確的是
下列有關說法正確的是
A.1mol CO(NH2)2分子中含有3mol δ鍵
B. CO(NH2)2分子中C原子、N原子的軌道雜化類型是均為sp3
C.組成尿素的四種元素第一電離能由大到小的順序是O、N、C、H
D.根據結構推測,尿素可能易溶于水,熔沸點高于丙酮![]()
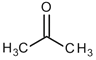
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項比較中前者高于(或大于或強于)后者的是
A. 金屬Mg和金屬Cu的空間利用率
B. BF3和CH4中心原子的價層電子對數
C. 鄰羥基苯甲醛(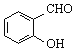 )和對羥基苯甲醛(
)和對羥基苯甲醛(![]() )的沸點
)的沸點
D. C-O和Si-O的鍵能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環境保護是現代的世界性課題,人類已在多方面取得了突破性進展。
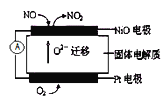
(1)連續自動監測氮氧化物![]() 的儀器--動態庫侖儀已獲得實際應用.它的工作原理如下圖所示,NiO電極上NO發生的電極反應式為 ______。
的儀器--動態庫侖儀已獲得實際應用.它的工作原理如下圖所示,NiO電極上NO發生的電極反應式為 ______。
(2)使用稀土催化劑有效消除汽車尾氣中的![]() 、碳氫化合物也已逐漸成為成熟技術.壓縮天然氣汽車利用這一技術將
、碳氫化合物也已逐漸成為成熟技術.壓縮天然氣汽車利用這一技術將![]() 、
、![]() 轉化成無毒物質,相關反應為:
轉化成無毒物質,相關反應為:
①![]()
②![]()
③![]()
則![]() ______(用
______(用![]() 和
和![]() 表示)。
表示)。
(3)實驗室在恒壓下,將![]() 和
和![]() 置于密閉容器中發生反應③,測得在不同溫度、不同投料比時,
置于密閉容器中發生反應③,測得在不同溫度、不同投料比時,![]() 的平衡轉化率如下表:
的平衡轉化率如下表:
投料比 | 400K | 500K | 600K |
1 |
|
|
|
2 |
|
|
|
①在![]() 與
與![]() 反應時,可提高
反應時,可提高![]() 轉化率的措施有 ______填編號
轉化率的措施有 ______填編號![]() 。
。
A 增加催化劑的表面積 ![]() 改用高效催化劑
改用高效催化劑 ![]() 降低溫度
降低溫度
D 增大壓強 ![]() 分離出
分離出![]()
![]() 減小
減小![]()
②![]() 時,將投料比為1的
時,將投料比為1的![]() 和
和![]() 的混合氣體共
的混合氣體共![]() ,充入容積為2L的裝有催化劑的密閉容器中,反應經過5min達到平衡,試計算反應在該溫度時的平衡常數______。(寫出計算過程,計算結果保留三位有效數字)
,充入容積為2L的裝有催化劑的密閉容器中,反應經過5min達到平衡,試計算反應在該溫度時的平衡常數______。(寫出計算過程,計算結果保留三位有效數字)
③若溫度不變,在反應進行到10min時將容器的容積快速壓縮為1L,請在答題卷表格中畫出![]() 內,容器中
內,容器中![]() 物質的量濃度c隨時間變化的曲線圖______。
物質的量濃度c隨時間變化的曲線圖______。
(4)SNCR是一種新型的煙氣脫氮環保技術,在有氧條件下,其脫氮原理是:![]() 和
和![]() 在
在![]() 催化劑表面的反應隨溫度的變化曲線如圖所示,圖中曲線表明,隨著反應溫度的升高,在有氧的條件下NO的轉化率有一明顯的下降過程,其原因可能是
催化劑表面的反應隨溫度的變化曲線如圖所示,圖中曲線表明,隨著反應溫度的升高,在有氧的條件下NO的轉化率有一明顯的下降過程,其原因可能是![]() 回答兩條
回答兩條![]() : ______。
: ______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.反應CaCO3(s)=CaO(s)+CO2(g),在常溫下不能自發進行,則該反應的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀釋后,溶液中 的值減小
的值減小
C.鉛蓄電池在放電過程中,負極質量增加,正極質量減少
D.鍋爐中沉積的CaSO4和BaSO4都可用飽和Na2CO3溶液浸泡,再將不溶物用稀鹽酸溶解除去
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com