
【題目】工業酸性廢水中的![]() 可轉化為
可轉化為![]() 除去,實驗室用電解法模擬該過程,結果如下表所示(實驗開始時溶液體積為
除去,實驗室用電解法模擬該過程,結果如下表所示(實驗開始時溶液體積為![]() 的起始濃度、電壓、電解時間均相同),下列說法中,不正確的是( )
的起始濃度、電壓、電解時間均相同),下列說法中,不正確的是( )
實驗 | ① | ② | ③ |
電解條件 | 陰、陽極均為石墨 | 陰、陽極均為石墨,滴加 | 陰極為石墨,陽極為鐵,滴加 |
| 0.922 | 12.7 | 57.3 |
A. 對比實驗①②可知,降低pH可以提高![]() 的去除率
的去除率
B. 實驗②中,![]() 在陰極放電的電極反應式是
在陰極放電的電極反應式是![]()
C. 實驗③中,![]() 去除率提高的原因是陽極產物還原
去除率提高的原因是陽極產物還原![]()
D. 實驗③中,理論上電路中每通過![]() 電子,則有
電子,則有![]()
![]() 被還原
被還原
【答案】D
【解析】
A.對比實驗①②,這兩個實驗中只有溶液酸性強弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大;
B.實驗②中,Cr2O72-在陰極上得電子發生還原反應;
C.實驗③中,Cr2O72-在陰極上得電子,陽極上生成的亞鐵離子也能還原Cr2O72-;
D.實驗③中,Cr2O72-在陰極上得電子,陽極上生成的亞鐵離子也能還原Cr2O72-,理論上電路中每通過3 mol電子,則有0.5 molCr2O72-在陰極上被還原,且溶液中還有Cr2O72-被還原。
A.對比實驗①②,這兩個實驗中只有溶液酸性強弱不同,其它外界因素都相同,且溶液的pH越小,Cr2O72-的去除率越大,所以降低pH可以提高Cr2O72-的去除率,A正確;
B.實驗②中,Cr2O72-在陰極上得電子發生還原反應,電極反應式為Cr2O72-+6e-+14H+=2Cr3++7H2O,故B正確;
C.實驗③中,Cr2O72-在陰極上得電子,陽極上Fe失電子生成Fe2+,亞鐵離子也能還原Cr2O72-,C正確;
D.實驗③中,Cr2O72-在陰極上得電子,陽極上Fe失電子生成Fe2+,亞鐵離子也能還原Cr2O72-,理論上電路中每通過3mol電子,根據電極反應式Cr2O72-+6e-+14H+=2Cr3++7H2O,則有0.5 molCr2O72-在陰極上被還原,同時陽極生成1.5molFe2+,根據得失電子守恒,溶液中還有0.25mol Cr2O72-被Fe2+還原,所以共有0.75mol Cr2O72-被還原,D錯誤;
故合理選項是D。


科目:高中化學 來源: 題型:
【題目】現有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X與Z、M都不在同一周期,Z的核電荷數是M的2倍。下列說法正確的是
A.簡單陽離子的氧化性:![]()
B.氣態氫化物的沸點:![]()
C.X、Z與M不可能存在同一離子化合物中
D.Y2Z的溶液:c(Y+):c(Z2-) > 2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于氧化還原反應的是( )
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.CuO+CO![]() Cu+CO2
Cu+CO2
C.NaOH+HCl=H2O+NaCl
D.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于電解質溶液中離子關系的說法正確的是( )
A. 0.1 mol·L-1NaHCO3溶液中離子濃度關系:c(Na+)=2c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B. 把0.2 mol/L NH4Cl溶液與0.1 mol/L NaOH溶液等體積混合后離子濃度關系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C. 常溫,向醋酸鈉溶液中滴加少量醋酸使其pH=7,則混合液中:c(Na+)=c(CH3COO-)
D. 在Na2CO3溶液中,c(H+)+c(![]() )+c(H2CO3)= c(OH-)
)+c(H2CO3)= c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有甲、乙、丙、丁四個裝置,下列說法不正確的是
A.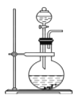 裝置甲可作為制取NO2的發生裝置
裝置甲可作為制取NO2的發生裝置
B. 裝置乙可作為制取NO的收集裝置
裝置乙可作為制取NO的收集裝置
C.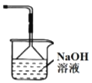 裝置丙可作為制取Cl2的尾氣吸收裝置
裝置丙可作為制取Cl2的尾氣吸收裝置
D. 裝置丁可用于除去NH3中H2O
裝置丁可用于除去NH3中H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
I.氨為重要的化工原料,有廣泛用途。
(1)合成氨中的氫氣可由下列反應制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
則反應CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始時投入氮氣和氫氣的物質的量分別為1mol、3mol,在不同溫度和壓強下合成氨。平衡時混合物中氨的體積分數與溫度的關系如圖。

①恒壓時,反應一定達到平衡狀態的標志是_____________(填序號)
A.![]() 和
和![]() 的轉化率相等 B.反應體系密度保持不變
的轉化率相等 B.反應體系密度保持不變
C.![]() 保持不變 D.
保持不變 D.![]()
②P1_____P2 (填“>”“=”或“不確定”,下同);反應的平衡常數:B點_______D點。
③C點![]() 的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
Ⅱ.用間接電化學法去除煙氣中NO的原理如下圖所示。
已知陰極室溶液呈酸性,則陰極的電極反應式為_____________。反應過程中通過質子交換膜(ab)的![]() 為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。
為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下圖點滴板上進行四個溶液間反應的小實驗,其對應反應的離子方程式書寫正確的是( )

A. a反應:Fe2++2H++H2O2=Fe3++2H2O
B. b反應:HCO3-+OH-=CO32-+H2O
C. c反應:H++OH-=H2O
D. d反應:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,屬于加成反應的是
A.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
C.2CH3CH2OH+O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由W、X、Y、Z四種金屬按下列裝置進行實驗。下列說法不正確的是
甲 | 乙 | 丙 | |
裝置 |
|
|
|
現象 | 金屬W不斷溶解 | Y 的質量增加 | W上有氣體產生 |
A.四種金屬的活動性強弱順序為Z>W>Y>X
B.裝置乙中Y電極上的反應式為Cu2++2e=Cu
C.裝置甲中X作原電池正極
D.裝置丙中溶液的c(H+)減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com