
【題目】多晶硅是制作光伏電池的關鍵材料。以下是由粗硅制備多晶硅的簡易過程。
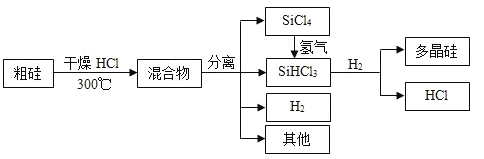
回答下列問題:
Ⅰ.硅粉與![]() 在300℃時反應生成
在300℃時反應生成![]() 氣體和
氣體和![]() ,放出
,放出![]() 熱量,該反應的熱化學方程式為_____________。
熱量,該反應的熱化學方程式為_____________。![]() 的電子式為__________________。
的電子式為__________________。
Ⅱ.將![]() 氫化為
氫化為![]() 有三種方法,對應的反應依次為:
有三種方法,對應的反應依次為:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氫化過程中所需![]() 高純度
高純度![]() 可用惰性電極電解
可用惰性電極電解![]() 溶液制備,寫出產生
溶液制備,寫出產生![]() 的電極名稱______(填“陽極”或“陰極”),該電極反應方程式為_______________。
的電極名稱______(填“陽極”或“陰極”),該電極反應方程式為_______________。
(2)反應③的![]() _______________(用
_______________(用![]() ,
,![]() 表示)。
表示)。
(3)由粗硅制備多晶硅過程中循環使用的物質除![]() 、
、![]() 和
和![]() 外,還有______(填分子式)。
外,還有______(填分子式)。
【答案】Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g)
SiHCl3(g)+H2(g) ![]() =-225mol-1
=-225mol-1  陰極 2H2O+2e-===H2
陰極 2H2O+2e-===H2![]() +2OH-
+2OH- ![]() HCl、H2
HCl、H2
【解析】
I. 依據熱化學方程式與熱量之間的關系書寫;參考CH4的電子式書寫SiHCl3的電子式;
II.(1)依據電解池的工作原理分析;
(2)根據根據蓋斯定律分析計算;
(3)結合流程圖分析。
I.根據題意,該反應的熱化學方程式為Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g) △H=-225kJ·mol-1; SiHCl3所有原子達穩定狀態,其電子式為
SiHCl3(g)+H2(g) △H=-225kJ·mol-1; SiHCl3所有原子達穩定狀態,其電子式為 ;
;
答案為Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g) △H=-225kJ·mol-1;
SiHCl3(g)+H2(g) △H=-225kJ·mol-1; ;
;
II.(1)根據電解原理,陰極上產生H2,即電極反應式為2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
答案為陰極:2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-;
(2)根據根據蓋斯定律,②-①得到反應③,即△H3=△H2-△H1;
答案為△H2-△H1;
(3)根據流程循環使用的物質有SiCl4、SiHCl3、Si、HCl、H2;
答案為HCl、H2。


 名師點撥卷系列答案
名師點撥卷系列答案科目:高中化學 來源: 題型:
【題目】實驗室用密度為1.18g/ml,質量分數為36.5%濃鹽酸配制250mL0.1mol/L的鹽酸溶液,填空并請回答下列問題:
(1)配制250mL0.1mol/L的鹽酸溶液
實際應量取鹽酸體積/ml | 應選用容量瓶的規格/mL | 除容量瓶外還需要的其它儀器 |
______________ | ______________ | ______________ |
(2)配制時,其正確的操作順序是(字母表示,每個字母只能用一次)______________;
A.用30mL水洗滌燒杯2—3次,洗滌液均注入容量瓶,振蕩
B.用量筒量準確量取所需的濃鹽酸的體積,沿玻璃棒倒入燒杯中,再加入少量水(約30mL),用玻璃棒慢慢攪動,使其混合均勻
C.將已冷卻的鹽酸沿玻璃棒注入250mL的容量瓶中
D.將容量瓶蓋緊,振蕩,搖勻
E.改用膠頭滴管加水,使溶液凹面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度1—2cm處
(3)操作A中,將洗滌液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢復到室溫,這是因為______________________________________;
(4)若出現如下情況,對所配溶液濃度將有何影響(填“偏高”、“偏低”或“無影響”)?若沒有進行A操作_______________;若加蒸餾水時不慎超過了刻度_______________;若定容時俯視刻度線___________________。
(5)若實驗過程中出現如下情況如何處理?加蒸餾水時不慎超過了刻度_______________;向容量瓶中轉移溶液時(實驗步驟②)不慎有液滴掉在容量瓶外面_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuSO4是一種重要的化工原料,有關制備途徑及性質如下圖所示。下列說法錯誤的是( )

A.途徑①所用混酸中H2SO4與HNO3的最佳物質的量之比為3:2
B.與途徑①、③相比,途徑②更好地體現了綠色化學思想
C.生成等量的硫酸銅,三個途徑中參加反應的硫酸的物質的量①=②<③
D.利用途徑②制備16g硫酸銅,被還原的硫酸的物質的量為0.1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用1.0mol·L -1NaOH溶液中和某濃度硫酸溶液時,其pH和所加NaOH溶液的體積(V)關系如右圖所示,則原硫酸溶液的物質的量濃度和恰好完全反應后溶液的總體積分別是(設二者混合后體積為二者體積之和)
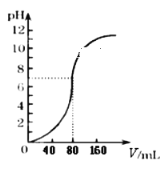
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中,只含有下表中所示的四種離子,則X離子及其個數b可能為( )
離子 | Na+ | Al3+ | Cl- | X |
個數 | 3a | 3a | 2a | b |
A.![]() 、4aB.
、4aB.![]() 、4aC.
、4aC.![]() 、8aD.
、8aD.![]() 、5a
、5a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鈣(Ca3N2)氮化鈣是一種棕色粉末,在空氣中氧化,遇水會發生水解,生成氫氧化鈣并放出氨。某化學興趣小組設計制備氮化鈣的實驗如下:
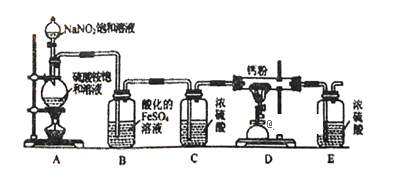
Ⅰ.氮化鈣的制備
(1)連接裝置后,檢查整套裝置氣密性的方法是_______________________________________。
(2)裝置A中每生成標準狀況下4.48LN2,轉移的電子數為___________________。
(3)裝置B的作用是吸收氧氣,則B中發生反應的離子方程式為______________________。裝置E的作用是______________________。
(4)實驗步驟如下:檢查裝置氣密性后,裝入藥品;_____________________(請按正確的順序填入下列步驟的代號)。
①點燃D處的酒精噴燈; ②打開分液漏斗活塞; ③點燃A處的酒精燈; ④停上點燃A處的酒精燈;⑤停止點燃D處的酒精噴燈
(5)請用化學方法確定氮化鈣中含有未反應的鈣,寫出實驗操作及現象_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2 通入 BaCl2 溶液中并不產生沉淀,而通入另一種氣體后可以產生白色沉淀。則圖中右側 Y 形管中放置的藥品組合符合要求的是( )
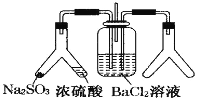
①Cu 和濃硝酸 ②CaO 和濃氨水 ③大理石和稀鹽酸④高錳酸鉀溶液和濃鹽酸 ⑤過氧化鈉和水 ⑥過氧化氫和二氧化錳
A. 全部B. ③⑤C. ①②⑤⑥D. ①②④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式中△H的含義表示正確的是
A. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H(中和熱)
B. NaOH(aq)+![]() H2SO4(濃)=
H2SO4(濃)=![]() Na2SO4(aq)+H2O(l) △H(中和熱)
Na2SO4(aq)+H2O(l) △H(中和熱)
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H(燃燒熱)
D. 2H2(g)+O2(g)=2H2O(g) △H(燃燒熱)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬及其化合物在人類生產、生活中發揮著重要的作用
(1)鈉、鋁、鐵三種金屬元素所形成的各種氧化物中具有強氧化性的是_____(填化學式,下同),適宜做耐火材料的是_____
(2)若Na2CO3粉末中混有少量 NaHCO3雜質,最適宜的除雜方法是_____,反應的化學方程式_____
(3)實驗室在保存含有Fe2+的溶液時,為了防止Fe2+變質,經常向其中加入鐵粉,其原因是_____(用離子方程式表示)
(4)Na2O2可用作呼吸面具中的供氧劑寫出有關反應的化學方程式_____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com