
下圖中A、E為常見金屬單質,D、G為常見氣體單質,B常溫下為無色無味的液體,E、F既能與鹽酸又能與燒堿溶液反應。據此回答下列問題:

(1)A在周期表中的位置是_________,E的原子結構示意圖是_________,G的同素異形體的分子式是_________。
(2)寫出①②兩個反應的化學方程式
①__________________________________,②_________________________________。
(3)F電解時陰極的電極反應式為__________________。用惰性電極電解B制D、G時,為加快電解速率,又不影響產物成分,可向其中加入下列物質中的(填字母)__________________。
A.CuCl2溶液 B.NaCl溶液 C.稀H2SO4 D.NaOH溶液
 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:
(13 分)
(1)CuSO4溶液是中學化學及工農業生產中常見的一種試劑。某同學利用CuSO4溶液,進行以下實驗探究。
① 圖一是根據反應Zn + CuSO4 = Cu + ZnSO4設計成的鋅銅原電池。電解質甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu極的電極反應式是 。
②圖二中,Ⅰ是甲烷燃料電池(電解質溶液為KOH溶液)的結構示意圖,該同學想在Ⅱ中實現鐵上鍍銅,則b處通入的是 (填“CH4”或“O2”),a處電極上發生的電極反應式是 。
(2)將藍礬(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波爾多液(殺菌劑),其 有效成分為難溶的堿式硫酸銅[xCuSO4·yCu(OH)2]。為測定某堿式硫酸銅的組成進行了如下實驗:取等質量的堿式硫酸銅樣品兩份,一份滴加稀鹽酸至恰好完全溶解,另一份高溫灼燒后只得到CuO固體。所得數據顯示n(HCl)︰n(CuO)=3︰2,則該堿式硫酸銅的化學式中x︰y= 。
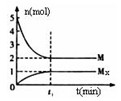
(3)E是非金屬性最強的元素,M是E的氣態氫化物,在固定體積的密閉容器中,氣體M存在如下關系:
xM(g)![]() Mx(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是
Mx(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是
A.該反應的化學方程式是2HF![]() (HF)2
(HF)2
B.平衡時混合氣體的平均摩爾質量是33.3
C.t1時刻,保持溫度不變,再充入1molM,重新達到平衡時, 將增大
將增大
D.M的沸點比同主族下一周期元素的氣態氫化物沸點低
查看答案和解析>>
科目:高中化學 來源:2011屆遼寧省鐵嶺中學高三第四次模擬考試(理綜)化學部分 題型:填空題
(13 分)
(1)CuSO4溶液是中學化學及工農業生產中常見的一種試劑。某同學利用CuSO4溶液,進行以下實驗探究。
① 圖一是根據反應Zn + CuSO4 =" Cu" + ZnSO4設計成的鋅銅原電池。電解質甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu極的電極反應式是 。
②圖二中,Ⅰ是甲烷燃料電池(電解質溶液為KOH溶液)的結構示意圖,該同學想在Ⅱ中實現鐵上鍍銅,則b處通入的是 (填“CH4”或“O2”),a處電極上發生的電極反應式是 。
(2)將藍礬(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波爾多液(殺菌劑),其有效成分為難溶的堿式硫酸銅[xCuSO4 ·yCu(OH)2]。為測定某堿式硫酸銅的組成進行了如下實驗:取等質量的堿式硫酸銅樣品兩份,一份滴加稀鹽酸至恰好完全溶解,另一份高溫灼燒后只得到CuO固體。所得數據顯示n(HCl)︰n(CuO)=3︰2,則該堿式硫酸銅的化學式中x︰y= 。
(3)E是非金屬性最強的元素,M是E的氣態氫化物,在固定體積的密閉容器中,氣體M存在如下關系:
xM(g) Mx(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是
Mx(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是 
A.該反應的化學方程式是2HF (HF)2 (HF)2 |
| B.平衡時混合氣體的平均摩爾質量是33.3 |
C.t1時刻,保持溫度不變,再充入1molM,重新達到平衡時, 將增大 將增大 |
| D.M的沸點比同主族下一周期元素的氣態氫化物沸點低 |
查看答案和解析>>
科目:高中化學 來源:2010-2011學年遼寧省高三第四次模擬考試(理綜)化學部分 題型:填空題
(13 分)
(1)CuSO4溶液是中學化學及工農業生產中常見的一種試劑。某同學利用CuSO4溶液,進行以下實驗探究。
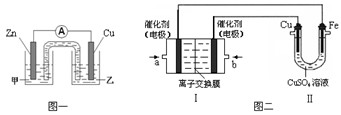
① 圖一是根據反應Zn + CuSO4 = Cu + ZnSO4 設計成的鋅銅原電池。電解質甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu極的電極反應式是 。
②圖二中,Ⅰ是甲烷燃料電池(電解質溶液為KOH溶液)的結構示意圖,該同學想在Ⅱ中實現鐵上鍍銅,則b處通入的是 (填“CH4”或“O2”),a處電極上發生的電極反應式是 。
(2)將藍礬(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波爾多液(殺菌劑),其 有效成分為難溶的堿式硫酸銅[xCuSO4 ·yCu(OH)2]。為測定某堿式硫酸銅的組成進行了如下實驗:取等質量的堿式硫酸銅樣品兩份,一份滴加稀鹽酸至恰好完全溶解,另一份高溫灼燒后只得到CuO固體。所得數據顯示n(HCl)︰n(CuO)=3︰2,則該堿式硫酸銅的化學式中x︰y= 。
(3)E是非金屬性最強的元素,M是E的氣態氫化物,在固定體積的密閉容器中,氣體M存在如下關系:
xM(g) Mx
(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是
Mx
(g),反應物和生成物的物質的量隨時間的變化關系如下圖。下 列說法正確的是
B.平衡時混合氣體的平均摩爾質量是33.3
C.t1時刻,保持溫度不變,再充入1molM,重新達到平衡時, 將增大
將增大
D.M的沸點比同主族下一周期元素的氣態氫化物沸點低
查看答案和解析>>
科目:高中化學 來源:專項題 題型:推斷題

查看答案和解析>>
科目:高中化學 來源: 題型:
(08浙江金麗衢十二校聯考)已知固體甲、E、I、F均為常見的單質,其中E在常溫下為氣態。G為白色膠狀沉淀,既能溶解于鹽酸,又能溶解于氫氧化鈉溶液。A在常溫下為氣態,與氧氣完全反應時的體積比是1:2。W是由三種處在不同短周期的元素組成的化合物,與水反應生成A和G時的化學計量數之比為1:3:3:1。各物質有如下圖所示的轉化關系(部分反應的產物未全部表示)。試回答下列問題: 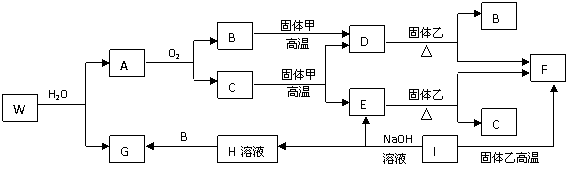
(1)B的電子式為 ,固體乙的化學式可能是 ;
(2)上述轉化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中屬于置換反應的是(填序號) ;
(3)寫出W和水反應的化學方程式____________________________________________,
I和NaOH溶液反應的離子方程式________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com