
【題目】(1)請寫出泡沫滅火器(硫酸鋁和碳酸氫鈉溶液) 滅火時發生反應的離子方程式:_______________。
(2)常溫下若溶液由pH=3的HA溶液V1mL 與pH=11的NaOH溶液V2mL混合而得正確的有_______________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,則V1一定大于V2
D.若混合后溶液呈堿性,則V1一定小于V2
(3)常溫下,濃度均為0.1mol/L的下列五種溶液的pH如表所示:
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根據表中數據,將濃度均為0.01mo/L的下列四種酸的溶液分別稀釋100倍,pH變化最小的是_________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根據以上數據,判斷下列反應可以成立的是_________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某溫度時,測得0.01mol·L-1 的NaOH溶液的pH為10。若將此溫度下pH=10的NaOH 溶液aL與pH=1的稀硫酸bL混合,(設混合后溶液體積的微小變化忽略不計),若所得混合液pH=2,則a:b=_______。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲線如圖。

①為減小實驗誤差,滴定時應選用適當的指示劑,判斷該滴定終點的現象為(必須描述顏色的變化)______________________。
②A、B、C三點所示溶液導電能力最強的是___________點對應的溶液;
③比較A、C兩點中水的電離程度:A_______C (填“>”、“ =”或“<”)。
(6)H2C2O4與含等物質的量的KOH的溶液反應后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為______________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,為制得純凈CuCl2溶液,宜加入__________調至溶液pH=4,使Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)=_________mol/L。[Fe(OH)3的Ksp=2.6×10-39]
【答案】 Al3++3HCO3-=Al(OH)3↓+3CO2↑ A、D A A、B 9:2 溶液由無色變為(淺)紅色,且30s內不褪色 C < c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) CuO(或CuCO3或Cu(OH)2或Cu2(OH)2CO3) 2.6×10-9
【解析】(1)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)A. 若混合溶液呈中性,則溶液中c(H+)=c(OH)=2×107molL1,所以溶液中c(H+)+c(OH)=2×107molL1,故A正確;B. 如果二者體積相等,如果酸是強酸,則混合溶液呈中性,如果酸是弱酸,則混合溶液呈酸性,故B錯誤;C. 如果溶液呈酸性,則溶液是酸和鹽溶液,酸是弱酸,酸濃度大于氫氧化鈉濃度,所以V1不一定大于V2,故C錯誤;D. 如果溶液呈堿性,則溶液可能是堿和鹽溶液,也可能只是鹽溶液,則V1一定小于V2,故D正確;故選AD;
(3)①相同濃度的鈉鹽溶液,酸的酸性越弱,則酸根離子水解程度越大,根據鈉鹽溶液pH確定酸的強弱;相同濃度的不同酸,加水稀釋促進弱酸電離,則稀釋相同的倍數,酸的酸性越弱,酸溶液稀釋過程中pH變化越小,根據鈉鹽溶液的pH知,HCN、HClO、CH3COOH、H2CO3四種酸的酸性大小順序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH變化最小的是HCN,故選A;
②HCN、HClO、CH3COOH、H2CO3四種酸的酸性大小順序是CH3COOH>H2CO3>HClO>HCN,根據強酸制取弱酸知:A. 酸性CH3COOH>H2CO3>HCO3-,所以二者反應為CH3COOH+Na2CO3═NaHCO3+CH3COONa,故正確;B. 醋酸酸性大于HCN,所以二者反應為CH3COOH+NaCN═CH3COONa+HCN,故正確;C. 碳酸酸性大于次氯酸,所以二者反應為CO2+H2O+NaClO═NaHCO3+NaClO,故錯誤;D. 酸性H2CO3>HClO>HCN,所以NaHCO3、HCN二者不反應,故錯誤;故選AB;
(4)若所得溶液的pH=2,則有(0.1b-0.01a)/(a+b)=0.01,a:b=9:2;
(5)①溶液由無色變為(淺)紅色,且30s內不褪色。②由圖兩者恰好完全反應,溶液呈堿性,C點是離子濃度最大導電能力最強,③酸電離的氫離子抑制水的電離,氫離子的濃度越大,水的電離程度越小,隨著氫氧化鈉的加入,溶液中氫離子濃度減小,所以水的電離程度增大,則水的電離程度A<C;
(6)H2C2O4與含等物質的量的KOH的溶液反應后溶質為KHC2O4,所得溶液呈酸性,則HC2O4的電離程度大于其水解程度,再結合氫離子來自水的電離和草酸氫根離子的電離,則:c(H+)>c(C2O42-)>c(OH-),溶液中離子濃度大小為:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(7)為得到純凈的CuCl22H2O晶體要除去氯化鐵,加入的物質和氯化鐵反應生成氫氧化鐵且不能引進新的雜質,所以加入物質后應能轉化為氯化銅,所以應該加入含銅元素和氫氧根離子的物質,可以是氧化銅或氫氧化銅或堿式碳酸銅,溶液的pH=4,所以溶液中氫離子濃度為10-4mol/L,則氫氧根離子濃度為10-10mol/L,c(Fe3+)=Ksp(Fe(OH)3)/c3(OH-)=2.6×10-39/(1×10-10)3=2.6×10-9mol/L故答案為:CuO或Cu(OH)2或Cu2(OH)2CO3;2.6×10-9mol/L;


科目:高中化學 來源: 題型:
【題目】T℃下,三種硫酸鹽MSO4 (M: Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲線如圖所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列說法正確的是
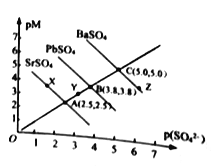
A. 溶度積:BaSO4>PbSO4>SrSO4
B. Y 點對SrSO4是不飽和溶液,能繼續溶解SrSO4
C. Z點對應的溶液中c(Ba2+)42-),二者的濃度積等于1×10-10
D. BaSO4不 可能轉化成PbSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語正確的是
A. 丙烯的電子式為: ![]()
B. 二乙酸乙二酯的結構簡式為: ![]()
C. 苯酚鈉溶液中通入少量CO2的離子方程式為:![]() +H2O+CO2
+H2O+CO2![]()
![]() +HCO3—
+HCO3—
D. 甲醛與足量的銀氨溶液反應的化學方程式為:HCHO+2Ag(NH3)2OH ![]() HCOONH4+2Ag↓+3NH3+H2O
HCOONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用CO 合成甲醇的化學方程式為CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。下列說法正確的是
CH3OH(g) △H<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。下列說法正確的是

A. 溫度:T1>T2>T3 B. 正反應速率:v(a)>v(c),v(b)>v(d)
C. 平衡常數:K(a)>K(c)>K(b)>K(d) D. 平均摩爾質量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為證明稀硝酸與銅反應產物中氣體為NO,設計右下圖實驗(實驗過程中活塞2為打開狀態),下列說法中不正確的是
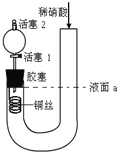
A. 關閉活塞1,加入稀硝酸至液面a處
B. 在裝置左側稍加熱可以加速銅的溶解
C. 通過關閉或開啟活塞1可以控制反應的進行
D. 反應開始后,膠塞下方有無色氣體生成,但不能證明該氣體為NO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鉻鐵礦[主要成分為Fe(CrO2)2;還含有Al2O3、Fe2O3、SiO2等雜質]為主要原料生產重鉻酸鈉晶體(Na2Cr2O7·2H2O,Na2Cr2O7是一種強氧化劑)的主要工藝流程如下:
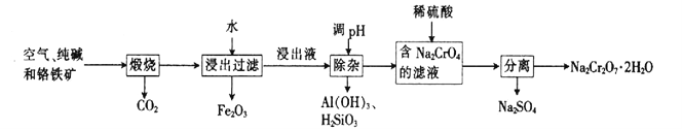
(1)亞鉻酸亞鐵[Fe(CrO2)2]中Cr的化合價是___________。
(2)煅燒生成Na2CrO4的化學方程式為___________。
(3)酸化濾液Na2CrO4時,不選用赴酸的原因是____________________,從平衡角度分析酸化的原理:______________________。
(4)該工藝中某種產物可以再利用,該物質的化學式為________________。
(5)采用石墨電極電解Na2CrO4溶液,可實現Na2CrO4→Na2Cr2O7的轉化,其原理如圖所示。,
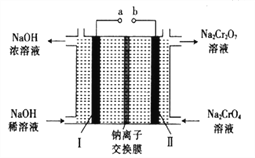
①寫出Ⅰ電極的電極反應式_______________________。
②當Na2CrO4轉化為1malNa2Cr2O7時,理輪上Ⅱ電極上轉移電子的物質的量為________。
(3)稱取2.500g重鉻酸鈉晶體試樣,加入蒸餾水配制成250ml溶液,從中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min。然后加入100mL水,加入3mL淀粉指示劑,用0.120mol·L-1的Na2S2O3標準溶液進行滴定(發生反應:I2+2S2O32-=2I-+S4O62-)。
①判斷達到滴定終點的依據是______________________。
②若實驗中共用去40.00mL,Na2S2O3標準溶液。則所得產品的純度為_____________(設整個過程中其他雜質不參如反應)(保留3位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關離子方程式或離子共存的敘述正確的是
A. 將磁性氧化鐵溶于氫碘酸: Fe3O4+ 8H+= 2Fe3++ Fe2+ + 4H2O
B. 用肥皂(主要成份C17H35COONa)檢驗含有較多鈣離子的硬水:2C17H35COO-+Ca2+=(C17H35COO)2Ca↓
C. 常溫下,在![]() =0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
D. 在NaClO溶液中:SO32-、OH-、Cl-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知化合物C為中學常見的化合物。
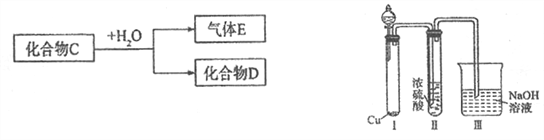
(1)若D是一種強酸,則C與水反應的化學方程式為__________________________。
有人認為“濃H2SO4可以干燥氣體C”,某同學為了驗證該觀點是否正確,用如右上圖裝置進行實驗。分液漏斗中應加入_______________,打開分液漏斗進行實驗,過程中,濃H2SO4中未發現有氣體逸出,且變為紅棕色,則你得出的解釋和結論是__________________。
(2)若D是一種常見的強堿,則C的電子式為:_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com