
海洋是生命的搖籃、資源的寶庫。中國要實施海洋強國戰略,實現由海洋大國向海洋強國邁進的夢想。海洋經濟已經成為拉動我國國民經濟發展的重要引擎,海水的綜合開發、利用是海洋經濟的一部分,海水中可提取多種化工原料,下面是工業上對海水的幾項綜合利用的示意圖。其流程如下圖所示:
(1)寫出①、②反應的離子方程式:
①______________________,②______________________。
(2)工業上利用電解飽和食鹽水產生的氫氣和氯氣制取鹽酸,為了體現綠色化學理念,使氯氣充分反應,采取將氯氣在氫氣中燃燒的辦法,可避免氯氣燃燒不完全污染空氣,請寫出氯氣在氫氣中燃燒的實驗現象:______________________。
(3)粗鹽中含有Ca2+、Mg2+、SO42-等雜質,精制后可得到飽和NaC1溶液。現有下列除雜試劑:A.鹽酸 B.氫氧化鋇溶液 C.碳酸鈉溶液。精制時加入過量除雜試劑的正確順序是______________。(填序號)
(4)金屬鎂在空氣中燃燒時,除生成MgO外,還有少量Mg3N2生成。把等物質的量的金屬鎂分別放在:A.純氧氣(O2)中;B.二氧化碳氣體中;C.空氣中。完全燃燒后,得到的固體物質的質量由大到小的順序是______________。(填序號)
(5)將電解飽和NaCl溶液生成的氯氣通入氫氧化鈉溶液中可以得到NaClO。某化學興趣小組探究NaClO與尿素CO(NH2)2的反應產物,通過實驗發現產物除某種鹽外,其余產物都是能參與大氣循環的物質,則該反應的化學方程式為____________。
(1)①2Cl-+2H2O  2OH-+Cl2↑+H2↑(3分)
2OH-+Cl2↑+H2↑(3分)
②Mg2++Ca(OH)2= Mg(OH)2↓+ Ca2+ (3分)
(2)發出蒼白色火焰(2分)
(3)BCA (2分)
(4)B>A>C(2分)
(5)3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
或NaOH+3NaClO+CO(NH2)2=3NaCl+NaHCO3+N2↑+2H2O
或2NaOH+3NaClO+CO(NH2)2=3NaCl+Na2CO3+N2↑+3H2O(3分)
解析試題分析:(1)根據題給流程圖知,反應①為電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣,離子方程式為
2Cl-+2H2O  2OH-+Cl2↑+H2↑;反應②為鎂離子和石灰乳的反應,離子方程式為
2OH-+Cl2↑+H2↑;反應②為鎂離子和石灰乳的反應,離子方程式為
Mg2++Ca(OH)2= Mg(OH)2↓+ Ca2+;(2)氯氣在氫氣中燃燒的實驗現象:發出蒼白色火焰;(3)粗鹽中含有Ca2+、Mg2+、SO42-等雜質,可用過量氫氧化鋇溶液除去鎂離子和硫酸根,用過量碳酸鈉溶液除去過量的鋇離子和鈣離子,過濾,用鹽酸調節濾液的PH,精制時加入過量除雜試劑的正確順序是BCA ;(4)設金屬鎂的物質的量為1mol,A.1mol鎂在純氧氣(O2)中燃燒生成1mol氧化鎂,質量為40g;B.1mol鎂在二氧化碳氣體中燃燒生成1mol氧化鎂和0.5mol碳,質量為46g;C.1mol鎂在空氣中完全燃燒生成氧化鎂和氮化鎂的混合物,質量小于40g,得到的固體物質的質量由大到小的順序是B>A>C;(5)NaClO與尿素CO(NH2)2的反應產物,通過實驗發現產物除某種鹽外,其余產物都是能參與大氣循環的物質,則該反應的化學方程式為3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O 。
考點:考查物質的分離提純、方程式的書寫及關系式法計算。


科目:高中化學 來源: 題型:填空題
新型材料納米級Fe粉具有超強的磁性,能用作高密度磁記錄的介質以及高效 催化劑等。
I.實驗室采用氣相還原法制備納米級Fe,其流程如下:
(1) 固體加熱脫水通常要通入 。
固體加熱脫水通常要通入 。
(2)生成納米級Fe的化學方程式為 。
Ⅱ.在不同溫度下,納米級Fe粉與水蒸氣反應的固體產物不同:溫度低于570℃時生成FeO,高于570℃時生成 。甲同學用下圖所示裝置進行納米級Fe粉與水蒸氣的反應并驗證固體產物。
。甲同學用下圖所示裝置進行納米級Fe粉與水蒸氣的反應并驗證固體產物。
(3)B中收集到的氣體是 (填名稱),C裝置的作用是 。
(4)乙同學為探究實驗結束后試管內的固體物質成分,進行了下列實驗:
乙同學認為該條件下反應的固體產物為FeO。丙同學認為該結論不正確,他的理由是 (用離子方程式表示)。
(5)丁同學稱取5.60gFe粉,反應一段時間后,停止加熱。將試管內的固體物質在干燥器中冷卻后,稱得質量為6.88g。然后將冷卻后的固體物質與足量FeCl3溶液充分反應,消耗0.08molFeCl3。丁同學實驗的固體產物為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
紅礬鈉(重鉻酸鈉:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工業、電鍍工業和皮革工業中做輔助劑,在化學工業和制藥工業中也可做氧化劑,應用領域十分廣泛。實驗室中紅礬鈉可用一種鉻鐵礦(主要成分:FeO·Cr2O3,還含有少量的Al2O3)通過以下過程來制取。
回答下列問題:
(1)步驟Ⅰ中反應化學方程式為4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在實驗室,步驟Ⅰ應在________(填“陶瓷”或“鐵”)坩堝中完成。
②在常溫下該反應速率極慢,下列措施中能使反應速率增大的是________(填字母)。
A.將原料粉碎 B.增加純堿的用量 C.升高溫度
(2)步驟Ⅱ中NaOH的作用是________________________(用化學反應方程式表示)。
(3)步驟Ⅳ中發生反應的離子方程式為________;反應完成的標志是________。
(4)利用下面的復分解反應,將紅礬鈉與KCl固體按1?2物質的量之比混合溶于水后經適當操作可得到K2Cr2O7晶體:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:溫度對氯化鈉的溶解度影響很小,對重鉻酸鉀的溶解度影響較大)
基本實驗步驟為①溶解;②________;③________;④冷卻,結晶,再過濾得K2Cr2O7晶體。其中③應在________(填“高溫”或“低溫”)條件下進行。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
海洋是一個豐富的資源寶庫,通過海水的綜合利用可獲得許多物質供人類使用。
(1) 海水中鹽的開發利用:
Ⅰ.海水制鹽目前以鹽田法為主,建鹽田必須選在遠離江河入海口,多風少雨,潮汐落差大且又平坦空曠的海灘。所建鹽田分為貯水池、蒸發池和_______池。
II.目前工業上采用比較先進的離子交換膜電解槽法進行氯堿工業生產,在電解槽中陽離子交換膜只允許陽離子通過,阻止陰離子和氣體通過,請說明氯堿生產中陽離子交換膜的作用____________________________________________。(寫一點即可)
(2)電滲析法是近年來發展起來的一種較好的海水淡化技術,其原理如下圖所示。請回答后面的問題: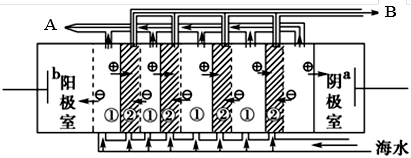
Ⅰ.海水不能直接通入到該裝置中,理由是_____________________________________________。
Ⅱ. B口排出的是________(填“淡水”或“濃水”)。
(3)用苦鹵(含Na+、K+、Mg2+、Cl-、Br-等離子)可提取溴,其生產流程如下: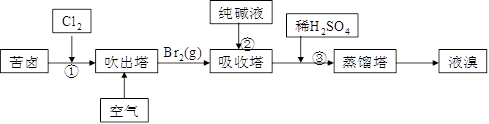
Ⅰ.若吸收塔中的溶液含BrO3-,則吸收塔中反應的離子方程式為_____________
_________________________________________。
Ⅱ.通過①氯化已獲得含Br2的溶液,為何還需經過吹出、吸收、酸化來重新獲得含Br2的溶液?_____________________________________________________________________。
Ⅲ.向蒸餾塔中通入水蒸氣加熱,控制溫度在900C左右進行蒸餾的原因是___________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二氧化鈰(CeO2)是一種重要的稀土氧化物。平板電視顯示屏生產過程中產生大量的廢玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物質)。某課題組以此粉末為原料回收鈰,設計實驗流程如下:
(1)洗滌濾渣A的目的是為了去除________(填離子符號),檢驗該離子是否洗凈的方法是___________________________________________________。
(2)第②步反應的離子方程式是__________________________________,濾渣B的主要成分是________。
(3)萃取是分離稀土元素的常用方法。已知化合物TBP作為萃取劑能將鈰離子從水溶液中萃取出來,TBP________(填“能”或“不能”)與水互溶。實驗室進行萃取操作時用到的主要玻璃儀器有________、燒杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4產品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4標準溶液滴定終點(鈰被還原為Ce3+),消耗25.00 mL標準溶液,該產品中Ce(OH)4的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氧化銅礦中含有主要雜質為Fe2+和Al3+等,用其生產CuSO4·5H2O主要工藝流程如下圖。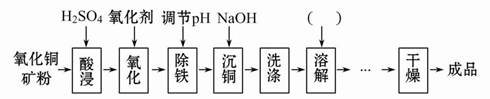
(1)圖中加入氧化劑的目的是 ,結合下表回答除鐵步驟的最佳pH范圍為 。
(2)氧化劑若選用KMnO4,會降低產品的純度,其原因是 ,實際生產中NaClO作為最佳氧化劑,發生反應的離子方程式為 。
(3)請在下圖中完善所缺步驟及所添加試劑的化學式。可供選擇的操作有:萃取、蒸發濃縮、過濾、洗滌、降溫結晶、蒸餾、分液。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
無水AlCl3可用作有機合成的催化劑、食品膨松劑等。工業上由鋁土礦(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下圖所示流程進行一系列反應來制備無水AlCl3。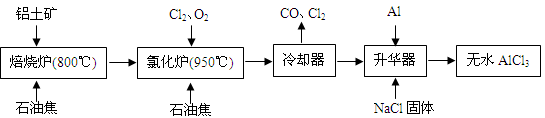
(1)氯化鋁在加熱條件下易升華,氣態氯化鋁的化學式為Al2Cl6,每種元素的原子最外層均達到8電子穩定結構,則AlCl3是: 晶體,其結構式為: 。
(2)氯化爐中Al2O3、Cl2和C反應的化學方程式是 。
(3)冷卻器排出的尾氣中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反應的離子方程式為: 。
(4)升華器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3產品中Fe元素含量直接影響其品質,為測定產品中Fe元素的含量,現稱取16.25g無水AlCl3產品,溶于過量的NaOH溶液,過濾出沉淀物,沉淀物經洗滌、灼燒、冷卻、稱重殘留固體質量為0.32g。則產品中Fe元素的含量為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
釩及化合物用途廣泛。工業上常用含少量Al2O3的釩鐵礦(FeO×V2O5)堿熔法提取V2O5。簡要流程如下:
已知:①焙燒時可發生反應:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
②常溫下物質的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是 。(寫化學式)
(2)生產中,不直接用H2SO4浸泡“燒渣A”獲取HVO3的原因是 。
(3)“操作①”包括 、洗滌。如果不洗滌,則產品中可能含有的金屬陽離子是 、 。下列裝置(部分夾持儀器省去)可用在實驗室進行“操作②”的是 。(填序號)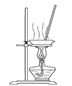

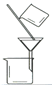
A B C D
(4)NaVO3用于原油的脫硫技術,由V2O5溶于NaOH溶液中制取,反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某工廠排出的污水中含有大量的Fe2+、Zn2+、Hg2+三種金屬離子。以下是某化學研究性學習小組的同學設計的除去污水中的金屬離子,回收綠礬、皓礬(ZnSO4·7H2O)和汞的方案。
[藥品] NaOH溶液、硫化鈉溶液、硫化亞鐵、稀硫酸、鐵粉
[實驗方案]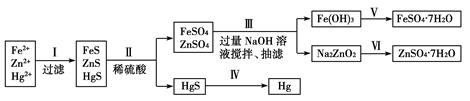
[問題探究]
(1)步驟Ⅱ所發生反應的離子方程式為_________________________________________________。
(2)步驟Ⅲ中的抽濾為減壓條件下的過濾,可以加快過濾速度;該步驟涉及反應的離子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步驟Ⅵ中得到硫酸鋅溶液的離子反應方程式為______________________________。
(4)欲實現步驟Ⅴ,所需加入的試劑有________、________,所涉及的主要操作依次為______________________。
(5)步驟Ⅳ常用的方法是加熱,該步驟是否對環境有影響?__________(填“是”或“否”),如有影響,請你設計一個環境保護方案來實現步驟Ⅳ的反應________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com