
【題目】合成氨工業、硫酸工業的生產工藝流程大致為:

合成塔和接觸室中的反應分別為:N2(g)+3H2(g)![]() 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)![]() 2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)寫出流程中設備的名稱:B____________,X___________。
(2)進入合成塔和接觸室中的氣體都要進行熱處理,最理想的熱處理方法是_________________。
(3)采用循環操作可提高原料的利用率,下列生產中,采用循環操作的是____________(填序號)。
①硫酸工業 ②合成氨工業 ③硝酸工業
(4)工業上常用98.3%的濃硫酸吸收SO3而不用稀硫酸或水的原因是_______________________。
(5)工業生產中常用氨——酸法進行尾氣脫硫,以達到消除污染、廢物利用的目的。硫酸工業尾氣中的SO2經處理可以得到一種化肥,該肥料的化學式是_____________。
【答案】循環壓縮機 沸騰爐 逆流換熱(或充分利用反應中放出的熱量加熱反應氣) ①②③ 由于用稀硫酸或水吸收SO3時易形成酸霧,不利于SO3吸收 (NH4)2SO4
【解析】
(1)為了提高原料的利用率,合成氨工業中從氨分離器分離出的N2、H2要循環使用,由于合成氨工業需要高壓,所以混合氣進入合成塔之前要壓縮,設備B為循環壓縮機;根據工業制硫酸的原理,煅燒硫鐵礦應在沸騰爐中進行,設備X為沸騰爐;
(2)由于合成氨和二氧化硫的催化氧化反應都是放熱反應,為了充分利用熱量,進入合成塔和接觸室中的氣體都要進行熱處理,最理想的熱處理方法是逆流換熱(或充分利用反應中放出的熱量加熱反應氣);
(3)只要在反應過程中使用的且在尾氣處理器中還剩余的物質都可以循環利用,故選①②③;
(4)工業上常用98.3%的濃硫酸吸收SO3而不用稀硫酸或水的原因是:用稀硫酸或水吸收SO3時易形成酸霧,不利于SO3吸收;
(5)氨水吸收SO2后得到亞硫酸銨,亞硫酸銨與硫酸反應后得到硫酸銨和可循環使用的SO2,所得化肥的化學式為(NH4)2SO4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】一定條件下,向一容積可變的密閉容量中充入2 mol X,發生反應:2X(g)![]() Y(g)+2Z(g),達到平衡后改變下述條件,氣體Z的平衡濃度不變的是( )
Y(g)+2Z(g),達到平衡后改變下述條件,氣體Z的平衡濃度不變的是( )
A. 恒溫恒壓下,充入1 mol X(g) B. 恒溫恒容下,充入1 mol Y(g)
C. 恒溫恒壓下,充入2 mol Z(g) D. 恒溫恒壓下,充入1 mol He(g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氨氣可與灼熱的氧化銅反應得到氮氣和金屬銅,用下圖中的裝置(省略夾持裝置及加熱裝置)可以實現該反應。實驗時C中粉末逐漸變為紅色,D中出現無色液體。下列有關說法正確的是 ( )
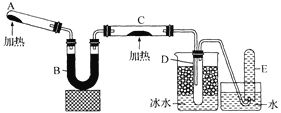
A.試管A中加入的試劑為NH4Cl固體
B.反應中氧化劑和還原劑的物質的量之比為2 : 3
C.裝置B中加入的物質可以是堿石灰或無水氯化鈣
D.裝置D中液體可以使干燥的紅色石蕊試紙變藍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。以下是關于合成氨的有關問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2在一定條件下發生反應:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則前5分鐘的平均反應速率v(N2)=__________。平衡時H2的轉化率為__________%。
2NH3(g)ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則前5分鐘的平均反應速率v(N2)=__________。平衡時H2的轉化率為__________%。
(2)平衡后,若提高H2的轉化率,可以采取的措施有__________。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(3)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
2NH3(g)ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K3 | 0.5 |
請完成下列問題:
①試比較K1、K2的大小,K1__________K2(填“<”“>”或“=”);
②400℃時,反應2NH3(g)![]() N2(g)+3H2(g)的化學平衡常數為__________。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化學平衡常數為__________。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正__________v(N2)逆(填“<”“>”或“=”)。
(4)根據化學反應速率和化學平衡理論,聯系合成氨的生產實際,你認為下列說法不正確的是__________。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.勒夏特列原理可指導怎樣使用有限原料多出產品
C.催化劑的使用是提高產品產率的有效方法
D.正確利用化學反應速率和化學反應限度理論都可以提高化工生產的綜合經濟效益
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關有機化合物的用途及性質的說法正確的是
A.乙烯使酸性KMnO4溶液或溴的CCl4溶液褪色的原理相同
B.苯與液溴在催化劑作用下生成溴苯發生了加成反應
C.淀粉、蛋白質等營養物質在人體內水解生成水和CO2等
D.用K2Cr2O7檢驗司機是否酒駕利用了乙醇的揮發性和還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學在環境保護中起著十分重要的作用,電化學降解![]() 的原理如圖所示。下列說法不正確的是
的原理如圖所示。下列說法不正確的是
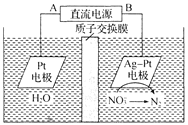
A.A為電源的正極
B.溶液中H+從陽極向陰極遷移,陰極區電解質溶液的pH保持不變
C.Ag-Pt電極的電極反應式為![]() +12H++10e-=== N2↑+6H2O
+12H++10e-=== N2↑+6H2O
D.電解過程中,每轉移2 mol電子,則左側溶液質量減少18 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下進行反應:COCl2(g)![]() Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
Cl2 (g)+CO(g)。向2.0 L恒容密閉容器中充入1.0 mol COCl2 (g),經過一段時間后達到平衡。反應過程中測得的有關數據見下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) /mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列說法正確的是 ( )
A.保持其他條件不變,升高溫度,平衡時c(Cl2) = 0.22 mol·L-1,則反應的 △H < 0
B.若在2 L恒容絕熱(與外界沒有熱量變換)密閉容器進行該反應,化學平衡常數不變
C.保持其他條件不變,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.6 mol CO,反應達到平衡前的速率:v (正) > v (逆)
D.保持其他條件不變,起始向容器中充入1.0 mol Cl2和0.8 mol CO,達到平衡時,Cl2的轉化率小于60%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸松油酯是松油醇的酯化產物,具有甜香氣味,廣泛應用于日用和食用香精中。乙酸松油酯的結構簡式如圖甲所示,下列說法正確的是
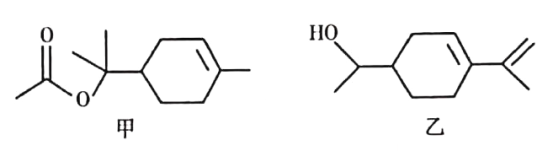
A. 乙酸松油酯的分子式為C12H22O2
B. 乙酸松油酯的水解產物松油醇與圖乙所示物質互為同分異構體
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質Ⅲ(2,3—二氫苯并呋喃)是一種重要的精細化工原料,其合成的部分流程如下:

下列敘述正確的是
A. 可用溴水可以鑒別化合物Ⅰ和Ⅱ
B. 物質Ⅰ在NaOH醇溶液中加熱可發生消去反應
C. 物質Ⅱ中所有原子可能位于同一平面內
D. 物質Ⅲ與足量H2加成所得產物分子中有2個手性碳原子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com