
【題目】在酸性溶液中,能大量共存的離子是( )
A.Mg2+、Fe2+、NO3—、Cl—B.Al3+、Fe2+、Cl—、SO42—
C.K+、Na+、Cl—、HCO3— D.Na+、Ba2+、NO3—、SO42—
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知:△G=△H-T△S,當△G<0,反應能自發進行,△G>0反應不能自發進行。某反應2AB(g)C(g)+3D(g)在高溫時能自發進行,在低溫下不能自發進行,則該反應的正反應的△H、△S應為
A.ΔH<0,△S<0B.△H<0, △S>0
C.△H>0,△S<0D.△H>0,△S>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種金屬片在稀鹽酸中,用導線連接,可以組成原電池,實驗結果如圖所示:則四種金屬的活潑性由強到弱的順序為( )
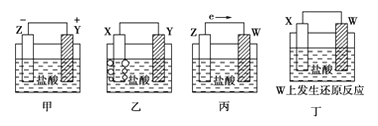
A. Z>Y>X>WB. Z>X>Y>WC. Z>Y>W>XD. Y>Z>X>W
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為原電池裝置示意圖。
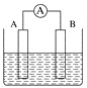
(1)將鋁片和銅片用導線相連,一組插入濃硝酸中,一組插入燒堿溶液中,分別形成了原電池,在這兩個原電池中,作負極的分別是_____(填字母)。
A.鋁片、銅片 B.銅片、鋁片
C.鋁片、鋁片 D.銅片、銅片
寫出插入燒堿溶液中形成的原電池的負極反應式____
(2)若A為Pb,B為PbO2,電解質為H2SO4溶液,工作時的總反應為Pb+PbO2+2H2SO4===2PbSO4+2H2O。寫出B電極反應式___,該電池在工作時,A電極的質量將___(填“增加”“減小”或“不變”)。若該電池反應消耗了0.1 mol H2SO4,則轉移電子的數目為___。
(3)若A、B均為鉑片,電解質為KOH溶液,分別從A、B兩極通入H2和O2,該電池即為氫氧燃料電池,寫出A電極反應式:_____;該電池在工作一段時間后,溶液的堿性將_____(填“增強”“減弱”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據表中數據,下列判斷正確的是( )

A. 在等濃度的NaF、NaH2PO4混合溶液中:c(Na+) + c(H+)=c(F-) + c(H2PO4-) + c(OH-)
B. 少量H3PO4和NaF反應的離子方程式為:H3PO4 +2F-===HPO42-+2HF
C. 同溫同濃度時,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 結合質子能力:PO43->HPO42->F-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界上人工方法首次合成的蛋白質—結晶牛胰島素是那個國家什么時候合成的( )
A.中國1965年B.德國1978年C.美國1932年D.中國1966年
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(用NA表示阿伏加德羅常數的值)
A. 17g羥基(-OH)所含有的電子數是10 NA個
B. 常溫下,14g乙烯含有的共用電子對數是2.5NA個
C. 12 g石墨中含有C﹣C鍵的個數為1.5NA
D. 標準狀況下,CH4發生取代反應生成22.4LCH2Cl2,需要消耗2NA個Cl2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式,正確的是( )
A. 甲烷的燃燒熱ΔH=-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,將0.5 mol N2(g)和1.5 mol H2(g)置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com