
【題目】在一定溫度下的密閉容器中,可逆反應 N2 + 3H2 ![]() 2NH3 達到平衡狀態的標志是
2NH3 達到平衡狀態的標志是
A.N2、H2、NH3 在容器中共存
B.混合氣體的總物質的量不再發生變化
C.單位時間內生成 n mol N2,同時生成 3n mol H2
D.單位時間內消耗 n mol N2,同時消耗 n mol NH3
【答案】B
【解析】
N2+3H22NH3為氣體體積縮小的可逆反應,該反應達到平衡狀態時,正逆反應速率相等,各組分的濃度、百分含量等變量不再變化,據此判斷。
A.該反應為可逆反應,則N2、H2、NH3在容器中始終共存,則無法判斷是否達到平衡狀態,故A錯誤;
B.該反應為氣體體積縮小的反應,平衡前氣體的總物質的量為變量,當混合氣體的總物質的量不再發生變化時,說明此時正、逆反應速率相等,達到平衡狀態,故B正確;
C.單位時間內生成nmolN2,同時生成3nmolH2,表示的都是逆反應速率,無法判斷是否達到平衡狀態,故C錯誤;
D.單位時間內消耗nmolN2,表示正反應速率,同時消耗nmolNH3,表示逆反應速率,但兩者速率之比與計量數之比不等,說明反應未達到平衡狀態,故D錯誤;
故答案為B。


科目:高中化學 來源: 題型:
【題目】能正確表示下列反應的離子方程式為( )
A.濃鹽酸與鐵屑反應:2Fe+6H+=2 Fe3++3H2↑
B.鈉與 CuSO4 溶液反應: 2Na + Cu2+ = Cu 2Na
C.足量Na2CO3溶液中清入幾滴稀H2SO4 :![]() + 2H+ = H2O + CO2
+ 2H+ = H2O + CO2
D.向 FeCl3 溶液中加入銅粉: Cu + 2Fe3+ = 2Fe2+ + Cu2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實,某化學興趣小組在實驗室中模擬上述過程,其設計的模擬裝置如下:
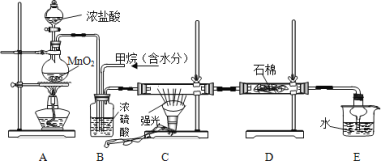
請回答:
(1)B 轉置有兩種功能:①干燥混合氣體;②_____。
(2)D 轉置的石棉中含有均勻混合了 KI 的淀粉糊,反應進行一段時間后其現象是_____。
(3)在 C 裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色固體小顆粒產生,你猜測生成黑色小顆粒的化學方程式可能是:_____。
(4)E 裝置除吸收了 HCl 外,還含有有機物,從 E 中分離出鹽酸的最佳方法為_____。該裝還有缺陷, 原因是沒有進行尾氣處理,其尾氣主要成分為_____(填序號)。
a.CH3Cl b.CH2Cl2 c.CHCl3 d.CCl4 e.CH4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物X的分子式為C5H12Cl,用NaOH的醇溶液處理X,可得到分子式為C5H10的兩種產物Y、Z。Y、Z經催化加氫后都可得到2-甲基丁烷.則X的結構簡式可能為( )
A.![]() B.
B.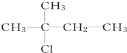
C.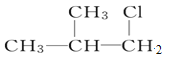 D.
D.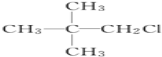
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下述實驗方案能達到實驗目的的是( )
A.驗證乙炔可與溴發生加成反應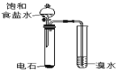
B.驗證淀粉水解產物具有還原性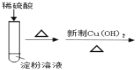
C.驗證溴乙烷發生消去反應產生乙烯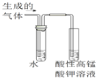
D.驗證碳酸的酸性強于苯酚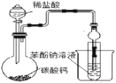
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①等物質的量濃度的兩種溶液:NaHA溶液的pH________(填“大于”“小于”或“等于”)Na2A溶液的pH。NaHA溶液中存在_______個平衡。
②某溫度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1mol·L-1 KOH溶液至溶液呈中性。此時該混合溶液中,下列關系中一定正確的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)<c(K+)
D.c(Na+)+c(K+)=0.1mol·L-1
③已知常溫下H2A的鈣鹽(CaA)的飽和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使該溶液中Ca2+濃度變小,可采取的措施有________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使該溶液中Ca2+濃度變小,可采取的措施有________。
A.升高溫度 B.降低溫度 C.加入NH4Cl晶體 D.加入Na2A固體
(2)已知:常溫時CH3COOH![]() CH3COO-+H+,Ka=2×10-5則反應CH3COO-+H2O
CH3COO-+H+,Ka=2×10-5則反應CH3COO-+H2O![]() CH3COOH+OH-的平衡常數Kh=________。
CH3COOH+OH-的平衡常數Kh=________。
(3)常溫下,若在0.10mol·L-1 CuSO4溶液中加入NaOH稀溶液充分攪拌,有淺藍色氫氧化銅沉淀生成,當溶液的pH=8時,c(Cu2+)=________mol·L-1{Ksp[Cu(OH)2]=2.2×10-20}。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是地殼中含量最多的金屬元素,其單質和化合物廣泛應用于日常生活中。
(1)鋁粉和鐵的氧化物(FeO-Fe2O3)可配成鋁熱劑用于焊接鋼軌,反應的化學方程式是____。
(2)以鋁土礦(主要成分為Al2O3.含SiO2和Fe2O3等雜質)為原料生產鋁和銨明礬晶體[NH4Al(SO4)2·12H2O]的一種工藝流程如下(已知:SiO2在“堿溶”時轉化為鋁硅酸鈉(NaAlSiO4·nH2O)沉淀)。

①實驗前,要將鋁土礦粉粹的目的是_______。
②用氧化物的形式表示鋁硅酸鈉的化學式________。
③步驟②涉及到的離子方程式是: _______。
④寫出利用Al2O3制備金屬Al的化學方程式: _______。
⑤若同時制取銨明礬和硫酸鋁,通過控制硫酸的用量調節兩種產品的產量。若欲使制得的銨明礬和硫酸鋁的物質的量之比為1:1,則投料時鋁土礦中的Al2O3和H2SO4的物質的量之比為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學可以變廢為室,利用電解法處理煙道氣中的NO,將其轉化為NH4NO3的原理如下圖所示,下列說法錯誤的是
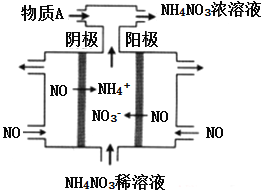
A. 該電解池的陽極反反為:NO-3e-+2H2O=NO3-+4H+
B. 該電解池的電極材料為多孔石墨,目的是提高NO的利用率和加快反應速率
C. 用NH4NO3的稀溶液代替水可以增強導電能力,有利于電解的順利進行
D. 為使電解產物全部轉化為NH4NO3,需補充物質A為HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO是大氣污染氣體,可利用化學反應進行治理或轉化。
(1)甲醇是重要的溶劑和燃料,工業上用CO和H2在一定條件下制備CH3OH的反應為:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①T℃時,向容積為2 L的恒容密閉容器中充入1 mol CO和1.2 mol H2,一段時間后達到平衡,此時H2與CH3OH的體積分數之比為2∶5,該反應的平衡常數K=____;此時若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),則平衡將____移動。(填“向正反應方向”、“不”或“向逆反應方向”)
②在一容積可變的密閉容器中充入一定物質的量的CO和H2,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。a、b、c三點平衡常數K(a)、K(b)、K(c)的大小關系是____。b、d兩點的正反應速率vb(CO)____vd(CO)。

(2)瀝青混凝土可作為2CO(g)+O2(g)![]() 2CO2(g)反應的催化劑。如圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
2CO2(g)反應的催化劑。如圖表示在相同的恒容密閉容器、相同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。

①a、b、c、d四點中表示平衡狀態的是____;
②相同條件下,____型瀝青混凝土催化效果更佳;
③e點轉化率出現突變的原因可能是____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com