
【題目】25°C時,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH隨加入NaOH溶液體積的變化關系如圖所示。下列說法正確的是( )
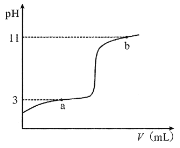
A.a點時,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a點和b點時水的電離程度相同
C.b點時,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL時,c(Na+)>c(A-)>c(H+)>c(HA)
【答案】A
【解析】
A.a點時,pH=3,c(H+) = 10-3 mol·L-1,因為Ka =1.0×10-3,所以c(HA) = c(A—),根據電荷守恒c(A—) + c(OH—) = c(Na+) + c(H+)和c(HA) = c(A—)即得c(HA)+c(OH-)=c(Na+)+c(H+),故A正確;
B.a點溶質為HA和NaA,pH=3,水電離出的c(OH—)=10—11;b點溶質為NaOH和NaA,pH=11,c(OH—) = 10-3,OH—是由 NaOH電離和水電離出兩部分之和組成的,推斷出由水電離處的c(OH—)<10-3,那么水電離的c(H+)>10—11,故B錯誤;
C.根據電荷守恒c(Na+) + c(H+) = c(A—) + c(OH—)可得c(Na+) = c(A—) + c(OH—)-c(H+),假設C選項成立,則c(A—) + c(OH—)-c(H+) = c(HA) + c(A— ) + c(OH—),推出c(HA) + c(H+) = 0,故假設不成立,故C錯誤;
D.V =10mL 時,HA與NaOH恰好完全反應生成NaA,A—+ H2O HA +OH—,水解后溶液顯堿性,c(OH—) > c(H+), 即c(HA) > c(H+) ,故D錯誤;
故答案選A。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】最近我國科學家研制出一種高分子大規模儲能二次電池,其示意圖如下所示。這種電池具有壽命長、安全可靠等優點,下列說法錯誤的是
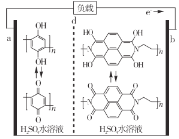
A.硫酸水溶液主要作用是增強導電性
B.充電時,電極b接正極
C.d膜是質子交換膜
D.充放電時,a極有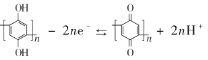
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖象表示的意義與相關的化學反應完全正確的是
A.向FeCl3溶液中不斷加入鐵粉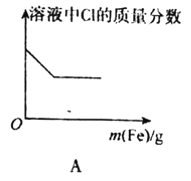
B.Fe(OH)2固體露置在空氣中質量的變化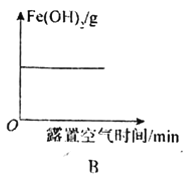
C.25℃時,向Cl2水溶液中通入二氧化硫(生成兩種常見的酸) 
D.向AlCl3溶液中不斷滴入燒堿溶液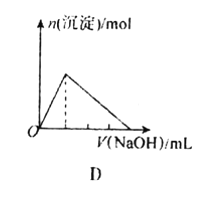
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚維酮碘的水溶液是一種常用的碘伏類緩釋消毒劑,聚維酮通過氫鍵與HI3形成聚維酮碘,其結構表示如圖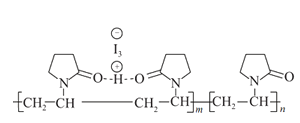 ,下列說法不正確的是( )
,下列說法不正確的是( )
A.聚維酮的單體是![]() B.聚維酮分子由(m+n)個單體聚合而成
B.聚維酮分子由(m+n)個單體聚合而成
C.聚維酮碘是一種水溶性物質D.聚維酮在一定條件下能發生水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法或有關化學用語的表達正確的是( )
A. 在基態多電子原子中,p軌道電子能量一定高于s軌道電子能量
B. 因氧元素電負性比氮元素大,故氧原子第一電離能比氮原子第一電離能大
C. 基態Fe原子的外圍電子排布圖為![]()
D. 根據原子核外電子排布的特點,Cu在元素周期表中位于s區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一定量含有Na2O雜質的Na2O2試樣,用下圖所示的實驗裝置測定Na2O2試樣的純度。(可供選用的試劑只有CaCO3固體、6 mol·L-1鹽酸、6 mol·L-1硫酸和蒸餾水)回答下列問題:
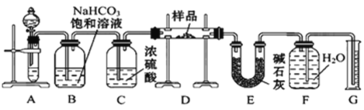
(1)裝置B的作用是___________________; 裝置E中堿石灰的作用是_________________________________。
(2)裝置D中發生反應的化學方程式是_________________;______________________.
(3)超氧化鉀(KO2)與過氧化鈉一樣能吸收CO2生成碳酸鹽及O2,寫出該反應的化學方程式_________________________。
(4)若開始時測得樣品的質量為2.0 g,反應結束后測得氣體體積為224 mL(標準狀況),則Na2O2試樣的純度為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維生素C,結構簡式如下圖。可用碘量法測定含量。取2片維生素C片劑,溶于蒸餾水,定容至250mL,取50mL,用0.0l0mol/LI2標準液滴定至終點,重復實驗,數據如下:
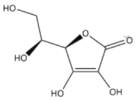
序號 | 滴定前讀數 | 滴定后讀數 |
1 | 1.00 | 25.98 |
2 | 1.24 | 25.36 |
3 | 1.38 | 26.40 |
已知:維生素C與I2按等物質的量恰好反應。
(1)該維生素C片溶液中維生素C的濃度為___mg/L。
(2)移取80mL橙汁于錐形瓶中,滴入lmL鹽酸調節酸度,用0.010mol/LI2的標準溶液滴定至終點,消耗標準液10.12mL,則橙汁中維生素C的含量為____mg/L。簡要寫出計算過程。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬酸鈉(Na2MoO4)是一種冷卻水系統的金屬緩蝕劑,工業上利用鉬精礦(主要成分為MoS2)制備金屬鉬和鉬酸鈉晶體的流程如下圖所示。
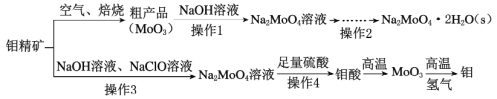
回答下列問題:
(1)如果在空氣中焙燒1mol MoS2時,S轉移12mol電子,則MoS2中鉬元素的化合價為____;焙燒產生的尾氣對環境的主要危害是___。
(2)若在實驗室中進行操作2,則從鉬酸鈉溶液中得到鉬酸鈉晶體的操作步驟是_,過濾、洗滌、干燥。
(3)鉬精礦中MoS2含量的測定:取鉬精礦16g,經在空氣中焙燒、操作1、操作2得到鉬酸鈉晶體(Na2MoO4·2H2O)12.1g(假設各步的轉化率均為100%),鉬精礦中MoS2的質量分數為_________。(已知MoS2的相對分子質量為160,Na2MoO4·2H2O的相對分子質量為242)。
(4)操作3硫元素被氧化為最高價,發生反應的離子方程式為_______。
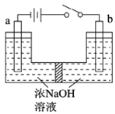
(5)用鎳、鉬作電極電解濃NaOH溶液制備鉬酸鈉(Na2MoO4)的裝置如圖所示。b電極上的電極反應式為____________。
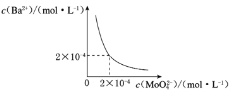
(6)某溫度下,BaMoO4在水中的沉淀溶解平衡曲線如圖所示,該溫度下BaMoO4的Ksp的值為____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com