
【題目】A、B、C、D、E為短周期元素且原子序數依次増大,質子數之和為40。B、C同周期,A、D同主族,A、C能形成兩種液態化合物A2C和A2C2,E的最高價氧化物的水化物呈兩性。
(1)B元素在周期表中的位置為_______。
(2)由A、C、D三種元素組成的化合物的電子式為_______。
(3)廢印刷電路版上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既達到了上述目的,又保護了環境,試寫出反應的化學方程式______。
(4)若BA3與C2可形成燃料電池,電解質為KOH溶液,則負極的電極反應式為______。(氧化產物不污染環境)
【答案】 第二周期第VA族 ![]() Cu+H2O2+H2SO4==CuSO4+2H2O 2NH3-6e-+6OH-=N2+6H2O
Cu+H2O2+H2SO4==CuSO4+2H2O 2NH3-6e-+6OH-=N2+6H2O
【解析】本題考查位置、結構、性質的關系及應用,明確元素的推斷是解答本題的關鍵,熟悉物質的性質及化學反應方程式的書寫即可解答,注意掌握原子結構與元素周期表、元素周期律的關系。
A、B、C、D、E為短周期元素且原子序數依次増大, A、C能形成兩種液態化合物A2C和A2C2,說明A為氫,C為氧元素,形成的為水或雙氧水,E的最高價氧化物的水化物呈兩性,說明E為鋁,質子數之和為40,所以計算B的質子數為7,為氮元素。(1)B元素為氮元素,在周期表中的位置為第二周期第VA族;(2)由A、C、D三種元素組成的化合物為氫氧化鈉,其電子式為![]() 。(3)廢印刷電路版上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現改用過氧化氫和稀硫酸浸泡既達到了上述目的,又保護了環境,說明銅和過氧化氫和硫酸反應也生成硫酸銅,反應的化學方程式為Cu+H2O2+H2SO4==CuSO4+2H2O。(4)若氨氣與氧氣可形成燃料電池,電解質為KOH溶液,氧氣在正極反應,則氨氣在負極反應,其電極反應式為2NH3-6e-+6OH-=N2+6H2O。
。(3)廢印刷電路版上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現改用過氧化氫和稀硫酸浸泡既達到了上述目的,又保護了環境,說明銅和過氧化氫和硫酸反應也生成硫酸銅,反應的化學方程式為Cu+H2O2+H2SO4==CuSO4+2H2O。(4)若氨氣與氧氣可形成燃料電池,電解質為KOH溶液,氧氣在正極反應,則氨氣在負極反應,其電極反應式為2NH3-6e-+6OH-=N2+6H2O。


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D、E代表原子序數依次增大的前四周期元素,其中A和C為同一主族,C常用于制作半導體器件和集成電路,B的簡單氫化物的水溶液呈堿性,E元素的正三價離子的3d亞層為半充滿,D被稱為“未來金屬”,其重量輕、強度高、耐腐蝕,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三種元素的第一電離能由小到大的順序為______________________,電負性由小到大的順序為____________________。
(2)B的簡單氫化物易液化的原因是_______________;BH4+中B原子的雜化方式為___________,空間構型為__________________。
(3)E元素基態原子的電子排布式為____________________________________。
(4)B和C形成的化合物常用作高溫耐火材料,化學性質穩定,據此推測它應屬于__________________晶體。
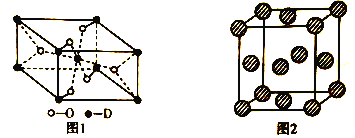
(5)D有多種氧化物,其中一種氧化物的晶胞結構如圖1所示,則該晶體中D的配位數為__________________;圖2為E的一種面心立方晶胞結構,若晶胞的邊長為acm,NA表示阿伏加德羅常數的值,則E的密度為__________________g·cm-3(用含a和NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某些化學鍵的鍵能,
化學鍵 | H﹣H | O=O | H﹣O |
鍵能(KJ/mol) | 436 | 496 | 463 |
對于反應:2H2(g)+O2(g)=2H2O(g)△H=a KJ/mol,a的值為( )
A.242
B.﹣242
C.484
D.﹣484
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在稀溶液中,酸跟堿發生中和反應生成1 mol水時的反應熱叫做中和熱。現利用如圖裝置進行中和熱的測定,請回答下列問題:

(1)圖示裝置有兩處重要組成部分未畫出,它們是____________ 、_______________。
(2)燒杯間填滿碎泡沫塑料的作用是 ________________。
(3)若操作時分幾次注入反應液,求得的反應熱數值_____(填“偏大”“偏小”或“無影響”)。
(4)做一次完整的中和熱測定實驗,溫度計需使用__________次。
(5)量取0.5 mol/L的鹽酸和0.55 mol/L的NaOH溶液各50 mL進行實驗,測得鹽酸和NaOH溶液起始平均溫度為t1℃,混合反應后最高溫度為t2℃,設溶液密度均為1 g/mL,生成溶液的比熱容c= 4.18 J/(g℃)。請列式計算中和熱:△H= ______________kJ/mol(不用化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于膠體的敘述不正確的是( )
A.膠體區別于其他分散系的本質特征是分散質的微粒直徑在1~100nm之間
B.光線透過膠體時,膠體中可發生丁達爾效應
C.Fe(OH)3膠體能夠吸附水中懸浮的固體顆粒并沉降,達到凈水目的
D.用聚光手電筒照射NaCl溶液和Fe(OH)3膠體時,產生的現象相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應N2 (g) + 3H2(g) ![]() 2NH3(g),2 min內N2濃度減少了0.6 mol﹒L-1,對此反應速率的描述正確的是( )
2NH3(g),2 min內N2濃度減少了0.6 mol﹒L-1,對此反應速率的描述正確的是( )
A. 2min內H2的反應速率是0.4 mol/(L﹒min)
B. 2 min內N2、H2、NH3的反應速率之比是1﹕2﹕3
C. 在2min內,N2的反應速率是0.3 mol/(L﹒min)
D. 在2min末NH3的反應速率是0.2 mol/(L﹒min)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com