
(1)現用物質的量濃度為amol/L的標準鹽酸去測定VmLNaOH溶液的物質的量濃度,請填寫下列空白:
①酸式滴定管用蒸餾水洗凈后,還應該進行的操作是_______________________。
②下圖是酸式滴定管中液面在滴定前后的讀數,則被測NaOH溶液的的物質的量濃度為:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有氣泡,滴定后滴定管尖嘴部分氣泡消失,則測得的NaOH溶液的物質的量濃度會偏_________________。
(2)平衡常數表明了封閉體系的可逆反應在給定的溫度下進行的程度,對于同一個類型的反應,平衡常數越大,表明反應進行的程度越大。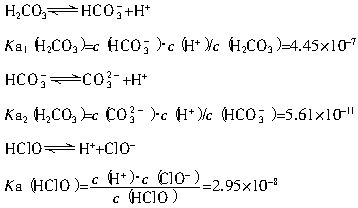
請依據以上碳酸和次氯酸的電離平衡常數,寫出在下列條件下所發生反應的離子方程式:
①將過量的氯氣通入到少量的碳酸鈉溶液中______________________________________;
②氯氣和碳酸鈉按照1∶1的比例恰好反應_____________________________________。
(3)鉻是1979年法國化學家沃克蘭在分析鉻鉛礦時首先發現的。鉻位于周期表中第四周期ⅥB族,其主要化合價為+6、+3、+2,其中+3較為穩定。某興趣小組對鉻的化合物進行探究性研究發現:Cr2O3微溶于水,與A12O3類似,是兩性氧化物;Cr(OH)3和Al(OH)3類似,也是兩性氫氧化物,在水中存在酸式和堿式電離平衡。Cr(OH)3酸式電離的電離方程式是:_________。
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
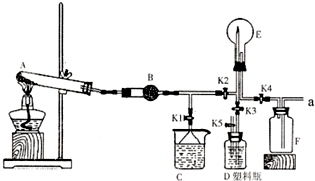 如圖是實驗室中某種氣體的制備、性質檢驗及收集裝置圖.
如圖是實驗室中某種氣體的制備、性質檢驗及收集裝置圖.
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| △ |
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 高溫 |
| 實驗步驟 | 操作 | 現象與結論 |
| 第一步 | 取少量液體裝于試管,向試 管中滴入幾滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,則說明含有Fe2+; 若無明顯變化,則說明不含Fe2+. |
查看答案和解析>>
科目:高中化學 來源: 題型:
實驗序號 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)寫出實驗過程中有關的離子方程式。
(2)由表格數據直接推測標準狀況下3.7 g樣品進行同樣實驗時,生成氨氣的體積為多少升?
(3)試計算該混合物中(NH4)2SO4和NH4HSO4的物質的量之比。
(4)欲計算該NaOH溶液的物質的量濃,度應選擇第_________組數據,由此求得NaOH溶液的物質的量濃度為多少?
查看答案和解析>>
科目:高中化學 來源: 題型:
為了防治環境污染并對尾氣進行綜合利用,某硫酸廠用氨水吸收尾氣中的SO2,再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體。為測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取樣品四份,分別加入相同濃度的NaOH溶液各40.00 mL,加熱至120 ℃左右,使氨氣全部逸出〔(NH4)2SO4和NH4HSO4分解溫度均高于200 ℃〕,測得有關實驗數據如下(標準狀況):
| 實驗序號 | 樣品的質量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(1)寫出實驗過程中有關的離子方程式。
(2)由表格數據直接推測標準狀況下3.7 g樣品進行同樣實驗時,生成氨氣的體積為多少升?
(3)試計算該混合物中(NH4)2SO4和NH4HSO4的物質的量之比。
(4)欲計算該NaOH溶液的物質的量濃,度應選擇第_________組數據,由此求得NaOH溶液的物質的量濃度為多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com