
【題目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液處理,使之轉(zhuǎn)化為疏松、易溶于酸的 CaCO3。某化學(xué)興趣小組用某濃度的 Na2CO3 溶液處理一定量的 CaSO4 固體,測(cè)得所加 Na2CO3 溶液體積與溶液中-lgc(CO32-)的關(guān)系如下:
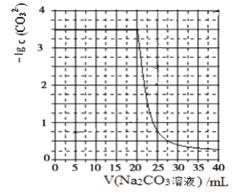
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列說(shuō)法不正確的是
A.曲線上各點(diǎn)的溶液滿足關(guān)系式![]()
B.CaSO4(s)+ ![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)K=3×103
(aq)K=3×103
C.該Na2CO3溶液的濃度為1.5 mol/L
D.相同實(shí)驗(yàn)條件下,若將Na2CO3溶液的濃度改為原濃度的2倍,則上圖曲線整體向上平移1個(gè)單位即可
【答案】CD
【解析】
A.用某濃度的 Na2CO3 溶液處理一定量的 CaSO4 固體,CaSO4沉淀轉(zhuǎn)化為CaCO3,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),根據(jù)平衡曲線,始終都有CaSO4固體,因此滿足![]() ,故A正確;
,故A正確;
B.CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),K=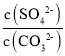 =
=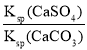 =
=![]() =3×103,故B正確;
=3×103,故B正確;
C.用某濃度的 Na2CO3 溶液處理一定量的 CaSO4 固體,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq) K=3×103,溶液體積就是碳酸鈉溶液的體積,每消耗1mol碳酸鈉生成1mol硫酸根離子,在硫酸鈣完全溶解前溶液中生成的硫酸根離子濃度等于碳酸鈉溶液的濃度,若碳酸鈉溶液濃度1.5mol/L,則硫酸根離子濃度為1.5mol/L,代入K=3×103,得到碳酸根離子濃度=0.5×10-3mol/L,-lgc(CO32-)=-lg(![]() ×10-3)=2.7,與圖象不一致,故C錯(cuò)誤;
×10-3)=2.7,與圖象不一致,故C錯(cuò)誤;
D.設(shè)碳酸鈉溶液濃度xmol/L,則硫酸根離子濃度為xmol/L,代入K=3×103,得到碳酸根離子濃度=![]() ×10-3mol/L,根據(jù)圖象,當(dāng)碳酸鈉溶液體積為20mL時(shí),-lgc(CO32-)=-lg(
×10-3mol/L,根據(jù)圖象,當(dāng)碳酸鈉溶液體積為20mL時(shí),-lgc(CO32-)=-lg(![]() ×10-3)=3.5,解得:x=1;相同實(shí)驗(yàn)條件下,若將碳酸鈉溶液的濃度改為原濃度的2倍,則消耗Na2CO3溶液體積為10mL,在CaSO4完全溶解前,c(SO42-)=2mol/L,K=
×10-3)=3.5,解得:x=1;相同實(shí)驗(yàn)條件下,若將碳酸鈉溶液的濃度改為原濃度的2倍,則消耗Na2CO3溶液體積為10mL,在CaSO4完全溶解前,c(SO42-)=2mol/L,K=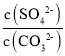 =3×103,推出溶液中c(CO32-)=
=3×103,推出溶液中c(CO32-)=![]() ×10-3mol/L,-lgc(CO32-)=-lg(
×10-3mol/L,-lgc(CO32-)=-lg(![]() ×10-3)=3.2,橫坐標(biāo)和縱坐標(biāo)都要改變,故D錯(cuò)誤;
×10-3)=3.2,橫坐標(biāo)和縱坐標(biāo)都要改變,故D錯(cuò)誤;
故選CD。


 閱讀快車(chē)系列答案
閱讀快車(chē)系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】制備乙酸乙酯的綠色合成路線之一為:
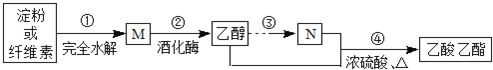
下列說(shuō)法正確的是( )
A.淀粉與纖維素互為同分異構(gòu)體
B.M的分子式為C12H22O11
C.N的結(jié)構(gòu)簡(jiǎn)式為C2H4O2
D.④的反應(yīng)類型屬于取代反應(yīng)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】測(cè)定有機(jī)化合物中碳和氫的組成常用燃燒分析法,下圖是德國(guó)化學(xué)家李比希測(cè)定有機(jī)物組成的裝置,氧化銅作催化劑,在750℃左右使有機(jī)物在氧氣流中全部氧化為CO2和H2O,用含有固體氫氧化鈉和氯化鈣的吸收管分別吸收CO2和H2O。

試回答下列問(wèn)題:
(1)甲裝置中盛放的是________,甲、乙中的吸收劑能否顛倒?________。
(2)實(shí)驗(yàn)開(kāi)始時(shí),要先通入氧氣一會(huì)兒,然后再加熱,為什么? _____________________。
(3)將4.6 g有機(jī)物A進(jìn)行實(shí)驗(yàn),測(cè)得生成5.4 g H2O和8.8 g CO2,則該物質(zhì)中各元素的原子個(gè)數(shù)比是________。
(4)經(jīng)測(cè)定,有機(jī)物A的核磁共振氫譜圖顯示有三組峰,則A的結(jié)構(gòu)簡(jiǎn)式為__________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】某課外研究性學(xué)習(xí)小組用下圖所示裝置制備少量溴苯并驗(yàn)證溴與苯的反應(yīng)是取代反應(yīng)。
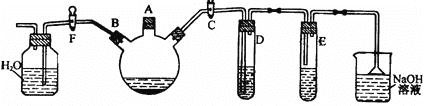
實(shí)驗(yàn)時(shí),關(guān)閉F活塞,打開(kāi)C活塞,在裝有少量苯的三口燒瓶中由A口加入少量液溴,再加入少量鐵屑,塞住A口。回答下列問(wèn)題:
(1)三口燒瓶中發(fā)生的化學(xué)反應(yīng)方程式為_______。
(2)D試管內(nèi)裝的是CCl4溶液,其作用是_______。
(3)除去溴苯中混有的Br2雜質(zhì)的試劑是______,操作方法為:___,有關(guān)化學(xué)方程式________。
(4)反應(yīng)完畢后,試管E(AgNO3溶液)中有___(填現(xiàn)象)生成,說(shuō)明這種獲得溴苯的反應(yīng)屬于_______反應(yīng)。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】下列有關(guān)電解質(zhì)溶液的說(shuō)法正確的是
A.25℃時(shí) pH=2 的 HF 溶液中,由水電離產(chǎn)生的 OH-濃度為 10-12 mol·L-1
B.0.1 mol·L-1 Na2CO3 溶液中:c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32- )
C.向 1 L 1 mol·L-1 的 NaOH 熱溶液中通入一定量 Br2,恰好完全反應(yīng)生成溴化鈉、次溴酸鈉和溴酸鈉(溴 酸為強(qiáng)酸、次溴酸為弱酸)的混合溶液:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-)
D.25℃時(shí) pH=3 的鹽酸與 pH=11 的氨水等體積混合,所得溶液的 pH<7
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】FeSO4 溶液放置在空氣中容易變質(zhì),因此為了方便使用 Fe2+,實(shí)驗(yàn)室中常保存硫酸亞鐵銨晶體[俗稱“摩爾鹽”,化學(xué)式為(NH4)2Fe(SO4)26H2O],它比綠礬或綠礬溶液更穩(wěn)定。(穩(wěn)定是指物質(zhì)放置 在空氣中不易發(fā)生各種化學(xué)反應(yīng)而變質(zhì))
I.硫酸亞鐵銨晶體的制備與檢驗(yàn)
(1)某興趣小組設(shè)計(jì)實(shí)驗(yàn)制備硫酸亞鐵銨晶體。
本實(shí)驗(yàn)中,配制溶液以及后續(xù)使用到的蒸餾水都必須煮沸、冷卻后再使用,這樣處理蒸餾水的目的是_______。向 FeSO4 溶液中加入飽和(NH4)2SO4 溶液,經(jīng)過(guò)操作_______、冷卻結(jié)晶、過(guò)濾、洗滌和干燥后得到一 種淺藍(lán)綠色的晶體。
(2)該小組同學(xué)繼續(xù)設(shè)計(jì)實(shí)驗(yàn)證明所制得晶體的成分。
①如圖所示實(shí)驗(yàn)的目的是_______,C 裝置的作用是_______。
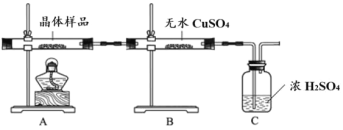
取少量晶體溶于水,得淡綠色待測(cè)液。
②取少量待測(cè)液,_______ (填操作與現(xiàn)象),證明所制得的晶體中有 Fe2+。
③取少量待測(cè)液,經(jīng)其它實(shí)驗(yàn)證明晶體中有NH4+和SO42-
II.實(shí)驗(yàn)探究影響溶液中 Fe2+穩(wěn)定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于兩支試管中,剛開(kāi)始兩種溶液都是淺綠色,分別同時(shí)滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分鐘后觀察可見(jiàn):(NH4)2Fe(SO4)2溶液仍然為淺綠色透明澄清溶液;FeSO4溶液則出現(xiàn)淡黃色渾濁。
(資料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
開(kāi)始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①請(qǐng)用離子方程式解釋 FeSO4 溶液產(chǎn)生淡黃色渾濁的原因_______。
②討論影響 Fe2+穩(wěn)定性的因素,小組同學(xué)提出以下 3 種假設(shè):
假設(shè) 1:其它條件相同時(shí),NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+穩(wěn)定性較好。
假設(shè) 2:其它條件相同時(shí),在一定 pH 范圍內(nèi),溶液 pH 越小 Fe2+穩(wěn)定性越好。
假設(shè) 3:_______。
(4)小組同學(xué)用如圖裝置(G為靈敏電流計(jì)),滴入適量的硫酸溶液分 別控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)為不同的 pH,

觀察記錄電流計(jì)讀數(shù),對(duì)假設(shè) 2 進(jìn)行實(shí)驗(yàn)研究,實(shí)驗(yàn)結(jié)果如表所示。
序號(hào) | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 電流計(jì)讀數(shù) |
實(shí)驗(yàn)1 | pH=1 | pH=5 | 8.4 |
實(shí)驗(yàn)2 | pH=1 | pH=1 | 6.5 |
實(shí)驗(yàn)3 | pH=6 | pH=5 | 7.8 |
實(shí)驗(yàn)4 | pH=6 | pH=1 | 5.5 |
(資料 2)原電池裝置中,其它條件相同時(shí),負(fù)極反應(yīng)物的還原性越強(qiáng)或正極反應(yīng)物的氧化性越強(qiáng),該原 電池的電流越大。
(資料 3)常溫下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液穩(wěn)定性更好。 根據(jù)以上實(shí)驗(yàn)結(jié)果和資料信息,經(jīng)小組討論可以得出以下結(jié)論:
①U 型管中左池的電極反應(yīng)式____________。
②對(duì)比實(shí)驗(yàn) 1 和 2(或 3 和 4) ,在一定 pH 范圍內(nèi),可得出的結(jié)論為____________。
③對(duì)比實(shí)驗(yàn)____________和____________,還可得出在一定pH 范圍內(nèi)溶液酸堿性變化對(duì) O2 氧化性強(qiáng)弱的影響因素。
④ 對(duì)(資料 3)實(shí)驗(yàn)事實(shí)的解釋為____________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是
A. 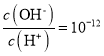 的溶液:NH4+、Cu2+、NO3-、SO42-
的溶液:NH4+、Cu2+、NO3-、SO42-
B.0.1 mol·L1的氨水:Cu2+、Na+、SO42-、NO3-
C.1 mol·L1的NaClO溶液:Fe2+、Al3+、NO3-、I
D.0.1 mol·L1的NaHCO3溶液:K+、Na+、NO3-、OH
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】用如右圖所示實(shí)驗(yàn)裝置(夾持儀器已略去)探究銅絲與過(guò)量濃硫酸的反應(yīng)。下列實(shí)驗(yàn)不合理的是( )

A. 上下移動(dòng)①中銅絲可控制SO2的量
B. ②中選用品紅溶液驗(yàn)證SO2的生成
C. ③中選用NaOH溶液吸收多余的SO2
D. 為確認(rèn)CuSO4生成,向①中加水,觀察顏色
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】D是一種催眠藥,F是一種香料,它們的合成路線如下:
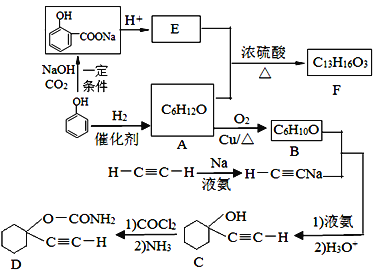
(1)A的化學(xué)名稱是_________,C中含氧官能團(tuán)的名稱為_______________。
(2)F的結(jié)構(gòu)簡(jiǎn)式為_______________,A和E生成F的反應(yīng)類型為_______________。
(3)B與乙炔鈉合成C的反應(yīng)類型(酸化前)是______________;寫(xiě)出由C合成D的第二個(gè)反應(yīng)的化學(xué)方程式___________________________________。
(4)同時(shí)滿足下列條件的E的同分異構(gòu)體有__________種(不含立體異構(gòu))。
①遇FeCl3溶液發(fā)生顯色反應(yīng); ②能發(fā)生銀鏡反應(yīng)
(5)以乙炔和甲醛為起始原料,選用必要的無(wú)機(jī)試劑合成1,3-丁二烯,寫(xiě)出合成路線(用結(jié)構(gòu)簡(jiǎn)式表示有機(jī)物,用箭頭表示轉(zhuǎn)化關(guān)系,箭頭上注明試劑和反應(yīng)條件)。_________
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com