
在C(s)+CO2(g) 2CO(g)反應中可使反應速率增大的措施是
2CO(g)反應中可使反應速率增大的措施是
①減小容器體積使增大壓強 ②增加碳的量 ③恒容時通入CO2
④恒壓下充入N2 ⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |
科目:高中化學 來源: 題型:單選題
反應X(g)+Y(g)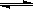 2Z(g); ΔH<0,達到平衡時,下列說法正確的是
2Z(g); ΔH<0,達到平衡時,下列說法正確的是
| A.減小容器體積,平衡向右移動 | B.加入催化劑,Z的產(chǎn)率增大 |
| C.增大c(X),X的轉化率增大 | D.降低溫度,Y的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
向甲、乙兩個容積均為1 L的恒溫恒容的密閉容器中,分別充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),發(fā)生反應:2SO2(g)+O2(g)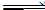 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。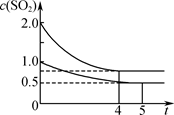
一段時間后達到平衡,測得兩容器中c(SO2)(mol·L-1)隨時間t(min)的變化關系如右圖所示。下列說法正確的是( )
| A.熱量:Q(甲)<2Q(乙) |
| B.壓強:p(甲)<2p(乙) |
| C.乙中前5 min內(nèi)的反應速率v(O2)=0.10 mol·L-1·min-1 |
| D.保持其他條件不變,若起始時向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,則此時v(正)<v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將BaO2放入密閉的真空容器中,反應2BaO2(s) 2BaO(s)+O2(g)達到平衡。保持溫度不變,縮小容器容積,體系重新達到平衡,下列說法正確的是
2BaO(s)+O2(g)達到平衡。保持溫度不變,縮小容器容積,體系重新達到平衡,下列說法正確的是
| A.平衡常數(shù)減小 | B.BaO量不變 | C.氧氣壓強不變 | D.BaO2量增加 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知圖①~④的相關信息,下列相應敘述正確的是 ( )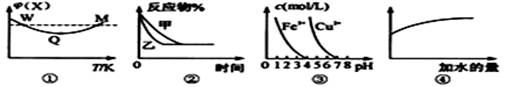
A.圖①表示向恒容密閉容器中充入X和Y發(fā)生反應:2X(g)+Y(g)  3Z(g) △H﹤0,W點X的正反應速率等于M點X的正反應速率 3Z(g) △H﹤0,W點X的正反應速率等于M點X的正反應速率 |
B.圖②表示壓強對可逆反應A(g)+2B(g) 3C(g)+D(s)的影響,乙的壓強比甲的壓強小 3C(g)+D(s)的影響,乙的壓強比甲的壓強小 |
| C.據(jù)圖③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常溫下,稀釋0.1mol/LNa2CO3溶液,圖④中的縱坐標可表示溶液中HCO3-的數(shù)目 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列圖示與對應的敘述相符的是 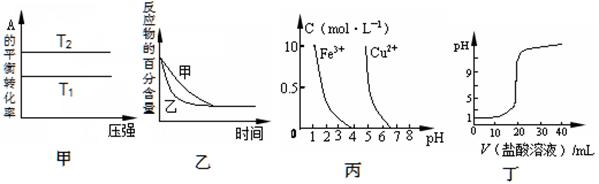
A.由圖甲可以判斷:若T1>T2,反應A(g)+ B(g) 2C(g)的△H<0 2C(g)的△H<0 |
B.圖乙表示壓強對可逆反應2A(g)+2 B(g) 3C(g)+D(s)的影響,乙的壓強比甲的壓強大 3C(g)+D(s)的影響,乙的壓強比甲的壓強大 |
| C.根據(jù)圖丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入適量NaOH溶液,調(diào)節(jié)pH≈4 |
| D.圖丁表示用0.1mol/L的鹽酸滴定20mL 0.1mol/LNaOH溶液,溶液pH隨加入鹽酸體積的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
實驗室中配制碘水,往往是將I2溶于KI溶液中,即可得到濃度較大的碘水,原因是發(fā)生了反應:I2(aq)+I-(aq)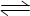 I3-(aq)。在反應的平衡體系中,c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態(tài))。
I3-(aq)。在反應的平衡體系中,c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態(tài))。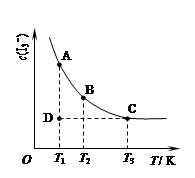
下列說法正確的是
A.該反應的正反應為放熱反應
B.A狀態(tài)與C狀態(tài)的化學反應速率大小為v(A)>v(C)
C.D狀態(tài)時,v正>v逆
D.欲配制濃度較大的氯水,可將氯氣通入氯化鉀溶液中
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
升高溫度,下列數(shù)據(jù)不一定同時增大的是 ( )
| A.化學反應速率v | B.弱電解質(zhì)的電離平衡常數(shù)Ka |
| C.化學平衡常數(shù)K | D.水的離子積常數(shù)KW |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
對于可逆反應2SO2+O2 2SO3,在混合氣體中充入一定量的18O2,足夠長的時間后,18O原子 ( )
2SO3,在混合氣體中充入一定量的18O2,足夠長的時間后,18O原子 ( )
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com