
【題目】碲(Te)被譽為尖端技術等工業的維生素。工業上常以粗銅精煉的陽極泥(主要成分是![]() ,含
,含![]() 等雜質)為原料提取碲并回收金屬,其工藝流程如下圖所示:
等雜質)為原料提取碲并回收金屬,其工藝流程如下圖所示:

已知:Te與S同一主族,比S原子多2個電子層;![]() 是兩性氧化物,微溶于水。請回答要求下列問題:
是兩性氧化物,微溶于水。請回答要求下列問題:
(1)碲的原子序數為___________;其最高價氧化物對應的水化物化學式為___________。該族2~5周期元素單質分別與反應生成1 mol氣態氫化物的反應熱如下,其中表示生成1 mol碲化氫反應熱的是(填序號字母)___________。
a. +99.7![]() b. -29.7
b. -29.7![]() c. -20.6
c. -20.6![]() d. -241.8
d. -241.8![]()
(2)步驟①中發生了(填“氧化”或“還原”或“非氧化還原”)___________反應;此過程控制pH不宜過低的原因是_________;“加壓”的目的是________________。
(3)步驟②當溫度過高時,會導致碲的浸出率降低,原因是____________。若從濾渣X中分離出Au ,需加入某試劑,該反應的化學議程式為_________________。
(4)步驟③銅從(填“陽”或“陰”)______極得到。寫出步驟④的離子方程式:_________。
【答案】52 ![]() a 氧化 防止
a 氧化 防止![]() 與酸反應 增大
與酸反應 增大![]() 濃度,加快反應速率,提高產率 使鹽酸揮發,
濃度,加快反應速率,提高產率 使鹽酸揮發,![]() 濃度降低 3Ag+4HNO3(稀)
濃度降低 3Ag+4HNO3(稀) ![]() 3AgNO3+NO↑+2H2O 陰
3AgNO3+NO↑+2H2O 陰 ![]()
【解析】
(1)Te是52號元素,原子最外層有6個電子,根據元素最高正化合價等于原子最外層電子數,確定最高價氧化物對應的水化物化學式;同一主族的元素形成的氫化物的穩定性逐漸減弱,物質物質含有的能量高;
(2)根據反應前后元素化合價是否發生變化判斷反應類型,結合![]() 是兩性氧化物,能夠與酸反應判斷反應條件的控制;增大壓強可使氧氣濃度增大,從反應速率及物質轉化率分析;
是兩性氧化物,能夠與酸反應判斷反應條件的控制;增大壓強可使氧氣濃度增大,從反應速率及物質轉化率分析;
(3)步驟②使用的鹽酸具有揮發性分析;根據硝酸具有氧化性,可以與Ag反應而不能與Au反應判斷;
(4)步驟③從CuSO4溶液中獲得銅單質,Cu被還原,應該從陰極得到;根據氧化還原反應原理,書寫步驟④的離子方程式。
(1)Te是52號元素,原子最外層有6個電子,最高化合價為+6價,其最高價氧化物對應的水化物的化學式為H2TeO4,由于從上到下原子核外電子層數逐漸增多,元素的非金屬性逐漸減弱,形成氫化物的穩定性逐漸減弱,由于物質所具有的能量越高,其穩定性就越差,所以根據選項提供的能量大小關系可知,表示生成1 mol碲化氫反應熱的是+99.7kJ/mol,因此選項a合理;
(2)Cu2Te在硫酸存在時,在加熱條件下與氧氣發生反應:Cu2Te+2O2+2H2SO4![]() 2CuSO4+TeO2+2H2O,由于反應前后Cu、Te、O元素的化合價發生了變化,因此該反應屬于氧化還原反應;在反應時溶液的pH不能過低,若pH過低,溶液的酸性過強,就會與反應產生的兩性氧化物TeO2發生反應;“加壓”可以增大氧氣的濃度,加快化學反應速率,使反應效率大大提高;
2CuSO4+TeO2+2H2O,由于反應前后Cu、Te、O元素的化合價發生了變化,因此該反應屬于氧化還原反應;在反應時溶液的pH不能過低,若pH過低,溶液的酸性過強,就會與反應產生的兩性氧化物TeO2發生反應;“加壓”可以增大氧氣的濃度,加快化學反應速率,使反應效率大大提高;
(3)步驟②用鹽酸溶解含TeO2的濾渣,由于鹽酸具有揮發性,升高溫度,使鹽酸揮發,c(H+)濃度降低,物質溶解速率降低;用鹽酸溶解后得到的濾渣X中含有Ag、Au,要分離二者,可以根據硝酸具有強氧化性,能夠與Ag反應的性質,該反應的化學方程式為:3Ag+4HNO3(稀) ![]() 3AgNO3+NO↑+2H2O;
3AgNO3+NO↑+2H2O;
(4)步驟③是從CuSO4溶液中獲得銅單質,Cu元素的化合價降低,被還原,發生還原反應,根據電解原理:陰極發生還原反應,所以Cu應該從陰極得到;步驟④是向TeCl4溶液中通入SO2會發生氧化還原反應,產生硫酸和Te單質,根據電子守恒、電荷守恒及原子守恒,可得該反應的離子方程式為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】化學是材料、能源、環境、信息等現代科學技術的重要基礎。下列說法不正確的是
A. 制造矢量發動機使用含錸(Re)合金材料,合金是純凈物
B. “人造太陽”的核燃料是氘、氚,12H、13H互為同位素
C. 在人體中檢測出了“微塑料”,說明白色污染危害嚴重
D. 制造芯片的工藝中,用氫氟酸腐蝕硅是化學變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物有廣泛的用途
(1)甲醇常作燃料,已知在常溫常壓下甲醇完全燃燒的熱化學方程式如下:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1。則2mol甲醇完全燃燒生成二氧化碳和氣態水時反應的ΔH______ΔH1(填“大于”、“等于”或“小于”)
(2)煤的綜合利用煤氣化是將水蒸氣通過紅熱的碳產生水煤氣:C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3kJ·molˉ1,達到平衡后,下列能提高水煤氣生成速率的措施是______。
A.升高溫度 B.增加碳的用量 C.縮小體積 D.用CO吸收劑除去CO
(3)一定溫度下,將一定量的C(s)和H2O(g)放入某恒容密閉容器中發生上述反應,得到如下數據:
達到平衡所需時間/s | 起始濃度/ mol·Lˉ1 | 平衡濃度/ mol·Lˉ1 |
H2O(g) | H2(g) | |
10 | 2.0 | 0.6 |
計算該反應從開始到平衡時,以CO表示的反應速率為______;H2O(g)的轉化率為______。
(4)下列可以說明反應C(s)+H2O(g)CO(g)+H2(g)已經達到平衡狀態的是____。
A.單位時間內生成nmolH2的同時,生成nmolCO
B.反應速率: (H2)= (CO)= (H2O)
C.c(H2O):c(CO):c(H2)=1:1:1
D.溫度和體積一定時,混合氣體的密度不再變化
E.溫度和體積一定時,容器內的壓強不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組的同學用圖所示裝置研究有關電化學的問題.當閉合該裝置的電鍵時,觀察到電流計的指針發生了偏轉.

請回答下列問題:
(1)甲池為______填“原電池”、“電解池”或“電鍍池”),通入 CH3OH 電極的電極反應為_____.
(2)乙池中 A(石墨)電極的名稱為_____(填“正極”、“負極”或“陰極”、“陽極”),總反應式為_____.
(3)當乙池中 B 極質量增加 5.40g 時,甲池中理論上消耗 O2 的體積為_____mL(標準狀況),丙池中_____極析出_____g 銅.
(4)若丙中電極不變,將其溶液換成 NaCl 溶液,電鍵閉合一段時間后,丙中溶液的 pH 將______________填“增大”、“減小”或“不變”);甲中溶液的 pH 將________________ (填“增大”、“減小”或“不變”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:A、B、F是家庭中常見的有機物,F常用于食品包裝,E是石油化工發展水平的標志。根據下面轉化關系回答問題。

(1)分別寫出A和E中官能團的名稱:A中_________;E中_________;
(2)操作⑥的名稱為________________。
(3)寫出反應類型:④_________;
(4)請寫出下列反應的化學方程式:
①寫出A和B在濃硫酸中加熱反應的方程式_________________;
②B在金屬銅存在下在空氣中加熱反應________________;
(5)F是一種常見的高分子材料,它給我們帶來了巨大的方便。然而,這種材料造成的當今的某一環境問題是__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)CH4與Cl2發生反應的條件是________;實驗中可觀察到量筒內液面________,量筒內壁出現油狀液滴,其中________是工業上重要的溶劑;飽和食鹽水中有少量固體析出,用飽和食鹽水而不用水的原因是______________________________。

(2)在濃硫酸作用下,苯在水浴加熱時可以與濃硝酸反應生成硝基苯,該反應的化學方程式為_____________
(3)寫出實驗室制取乙酸乙酯的化學方程式:__________________________________;實驗中飽和碳酸鈉溶液的作用是(填字母)________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中更小,有利于分層析出
D.加速酯的生成,提高其產率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加過程中,溶液中
溶液,滴加過程中,溶液中![]() 與
與![]() 溶液體積(V)的關系如圖所示,下列說法正確的是( )已知:
溶液體積(V)的關系如圖所示,下列說法正確的是( )已知: ![]() 。
。
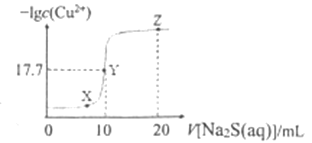
A. 該溫度下 ![]()
B. X、Y、Z三點中,Y點水的電離程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 濃度均為
濃度均為![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰空氣電池是一種用鋰作負極,以空氣中的氧氣作為正極反應物的電池。其工作原理如圖,下列說法中錯誤的是( )

A. 多孔電極可以提高電極與電解質溶液的接觸面積,并有利于氧氣擴散至電極表面
B. 正極的電極反應:![]()
C. 有機電解液可以是乙醇等無水有機物
D. 充電時專用充電電極可防止空氣極腐蝕和劣化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬(Mo)是一種難熔稀有金屬,我國的鉬儲量居世界第二。鉬及其合金在冶金,農業、電器、化工、環保等方面有著廣泛的應用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
則ΔH3 =________________(用含ΔH1、ΔH2的代數式表示),在反應③中若有0.2mol MoS2參加反應,則轉移電子_______________mol。
(2)密閉容器中用Na2CO3(S)作固硫劑,同時用一定量氫氣還原輝鉬礦(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,實驗測得平衡時的有關變化曲線如圖所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,實驗測得平衡時的有關變化曲線如圖所示:

①由圖可知,該反應的ΔH_____0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反應在體積不變的密閉容器中達平衡,下列說法錯誤的是______(選填編號)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,則H2轉化率增大
C.容器內氣體的密度不變時,一定達平衡狀態
D.容器內壓強不變時,一定達平衡狀態
③由圖可知M點時氫氣的平衡轉化率為________ (計算結果保留0.1%)。
④平衡常數可用平衡分壓代替平衡濃度計算,氣體分壓=氣體總壓×物質的量分數。求圖中M點的平衡常數Kp=________________________(MPa)2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com