
【題目】化學基本概念是學習化學的基石,請正確回答下列問題。
(1)今有7種物質:①液態氯化氫 ②乙醇 ③熔融的KNO3 ④銅線 ⑤NaCl晶體 ⑥小蘇打溶液 ⑦氨水。屬于電解質的是___________,屬于非電解質的是_____________。將①加入到⑦中,⑦的導電能力_______(填“增強”、“減弱”或“基本不變”)。
(2)漂白粉中加入鹽酸,可產生氯氣,化學方程式為:Ca(ClO)2+4HCl = CaCl2 +2Cl2+2H2O。用雙線橋法表示該反應中電子轉移的方向和數目_________,當有0.1 mol電子發生轉移時,生成氯氣的體積為_______L(標況下),被氧化的HCl為______mol。
(3)“四種基本反應類型與氧化還原反應的關系”如圖所示:
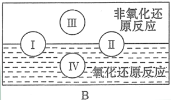
其中Ⅰ為化合反應,Ⅳ是_________反應。現有以下反應模型:單質A + 氧化物B=單質C + 氧化物D(A、B、C、D均為中學階段常見物質,反應條件已略去),寫出符合上述反應模型的化學反應方程式。
①若A為金屬單質,B為非金屬氧化物:_________________________。
②若A和C均為固體非金屬單質:_______________________________。
(4)濃硫酸有強氧化性,常溫下,向碳素鋼(僅含鐵、碳元素的合金)中加入少量濃硫酸,無明顯現象,原因是:____________________,加熱后,可能產生的氣體有___________________。
【答案】①③⑤ ② 增強 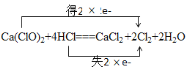 2.24 0.1 置換 2Mg+CO2
2.24 0.1 置換 2Mg+CO2![]() 2MgO+C 2C+SiO2
2MgO+C 2C+SiO2![]() Si+2CO↑ ①常溫下C和濃硫酸不反應,②常溫下鐵在濃硫酸中鈍化 CO2、SO2、H2
Si+2CO↑ ①常溫下C和濃硫酸不反應,②常溫下鐵在濃硫酸中鈍化 CO2、SO2、H2
【解析】
(1)①液態氯化氫在水中可以發生電離,該物質是電解質;
②乙醇在水中或者熔融狀態下不能電離,該物質是非電解質;
③熔融的KNO3可以導電,該物質是電解質;
④銅線可以導電,但該物質屬于單質,不屬于電解質的研究范疇,故該物質既不是電解質,也不是非電解質;
⑤NaCl晶體在溶液中或者熔融狀態下可以電離,該物質是電解質;
⑥小蘇打溶液是混合物,不屬于電解質的研究范疇,故該物質既不是電解質,也不是非電解質;
⑦氨水是混合物,不屬于電解質的研究范疇,故該物質既不是電解質,也不是非電解質;
故屬于電解質的是①③⑤;屬于非電解質的是②;
⑦氨水中的NH3·H2O是弱電解質,在水中不能完全電離,加入①液態氯化氫之后,生成強電解質NH4Cl,溶液導電性會增強;
(2)該反應的電子轉移方程式為: ,根據電子轉移方程式可知:每生成2份Cl2,轉移2份電子,需要4份HCl,有2份HCl作還原劑,有2則轉移0.1mol電子,生成0.1mol Cl2,即2.24L(標況),被氧化的HCl有0.1mol;
,根據電子轉移方程式可知:每生成2份Cl2,轉移2份電子,需要4份HCl,有2份HCl作還原劑,有2則轉移0.1mol電子,生成0.1mol Cl2,即2.24L(標況),被氧化的HCl有0.1mol;
(3)四大基本反應類型中,置換反應中一定有化合價變化,一定是氧化還原反應;化合反應、分解反應中,有的有化合價變化,有的沒有化合價變化,故部分化合反應、分解反應屬于氧化還原反應;復分解反應沒有化合價的變化,一定不是氧化還原反應;故若I為化合反應,II為分解反應,III為復分解反應,IV為置換反應;
符合題中反應模型的化學反應方程式,①2Mg+CO2![]() 2MgO+C;②2C+SiO2
2MgO+C;②2C+SiO2![]() =Si+2CO↑;
=Si+2CO↑;
(4)常溫下,C和濃硫酸不反應,鐵在濃硫酸中鈍化,故無明顯現象;加熱后,C、Fe會和濃硫酸反應生成CO2、SO2,隨著反應的進行,濃硫酸會變為稀硫酸,則未被氧化的Fe還會和稀硫酸反應生成H2,故可能生成的氣體有CO2、SO2、H2。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】工業常用FeCl3溶液腐蝕附在絕緣板上的銅箔,制造印刷電路板。
(1)寫出FeCl3溶液與金屬銅反應的離子方程式____________________
(2)某小組采取下列步驟從使用過的腐蝕廢液中回收銅,并重新獲得FeCl3溶液。
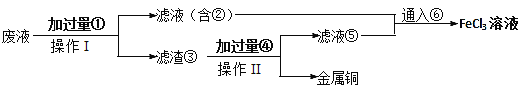
操作Ⅰ和Ⅱ的操作使用到的主要玻璃儀器有____,濾渣③含有的單質有______。通入氣體⑥的化學式為______。
(3)若某腐蝕液中含1.5mol·L-1CuCl2、3.0mol·L-1FeCl2、1.0mol·L-1FeCl3,取200mL腐蝕液按上述步驟回收銅,為充分回收銅,加入①的質量最小為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向10mL0.2mol·L-1的KIO3溶液中逐漸加入NaHSO3粉末,生成的I2的物質的量隨所加NaHSO3的物質的量變化如圖所示,下列說法不正確的是( )
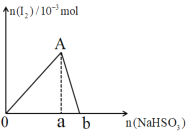
A.A點對應的I2的物質的量為1.0×10-3mol
B.0a:ab=5:1
C.當溶液中的n(I2)=5×10-4mol時,加入NaHSO3的物質的量可能為2.5×10-3mol或4.5×10-3mol
D.由ab段反應可知,氧化性I2>HSO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳元素形成的有機化合物在動植物體內及人類生存環境中有著相當廣泛的存在,起著非常重要的作用。請結合下列有關含碳化合物的研究,完成下列填空。
(1)為了高效利用能源并且減少CO2的排放,可用下列方法把CO2轉化成甲醇燃料:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=akJmol1
②2H2(g)+O2(g)=2H2O(g) △H=bkJmol1
③CH3OH(g)=CH3OH(l) △H=ckJmol1
④H2O(g)=H2O(l) △H=dkJmol1
則表示CH3OH(l)燃燒熱的熱化學方程式為___。
(2)用甲醇燃料電池電解處理酸性含鉻廢水(主要含有Cr2O72),用如圖裝置模擬該過程:
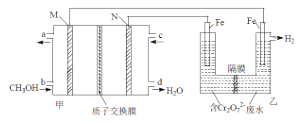
①請完成電解池中Cr2O72轉化為Cr3+的離子方程式___。
②當甲池中消耗甲醇1.6g時,乙池中兩電極的質量差為___g。
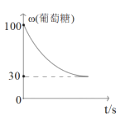
(3)葡萄糖和果糖為同分異構體,在一定條件下,C6H12O6(葡萄糖)![]() C6H12O6(果糖) △H﹤0。該反應的速率方程式可表示為v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定溫度下為常數,分別稱作正、逆反應速率常數。T1溫度下,k(正)=0.06s1,k(逆)=0.002s1。
C6H12O6(果糖) △H﹤0。該反應的速率方程式可表示為v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定溫度下為常數,分別稱作正、逆反應速率常數。T1溫度下,k(正)=0.06s1,k(逆)=0.002s1。
①T1溫度下,該反應的平衡常數K1=___。
②該反應的活化能Ea(正)___Ea(逆)(填“大于”、“小于”或“等于”)。
③該T2溫度下,從開始反應到平衡的過程中,葡糖糖的質量分數變化如圖所示。可以確定溫度T2___T1(填“大于”、“小于”或“等于”)。
(4)H2A為二元弱酸。室溫下配制一系列c(H2A)+c(HA)+c(A2)=0.100molL1的H2A與NaOH的混合溶液。測得H2A、HA、A2的物質的量分數c(x)%(c(x)%=![]() ×100%)隨pH變化如圖所示。
×100%)隨pH變化如圖所示。
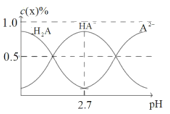
①當c(Na+)=0.100molL1時,溶液中離子濃度的大小順序為___。
②室溫下,若將0.100molL1的H2A與amolL1的NaOH溶液等體積混合,使溶液的pH=7。則H2A的Ka2=___molL1(用a表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作能達成實驗目的且涉及到氧化還原反應的是( )
選項 | 實驗目的 | 實驗操作 |
A | 除去 | 先后通過盛有酸性 |
B | 除去 | 加入過量 |
C | 檢驗溶液中含有 | 加入 |
D | 檢驗稀硫酸催化淀粉水解的產物為葡萄糖 | 向水解后的溶液中直接加入新制 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據實驗方案和現象對濃硫酸性質做出的判斷合理的是
實驗方案 | 實驗I: | 實驗II: |
實驗現象 | 試紙中心區域變黑,邊緣變紅 | 黑色固體溶解,溶液接近無色(溶液中錳元素僅以 |
A.由I可知,濃硫酸具有脫水性B.由I可知,濃硫酸具有弱酸性
C.由II可知,濃硫酸具有強氧化性D.由II可知,濃硫酸具有吸水性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把4.48L CO2通過一定量的固體過氧化鈉后收集到3. 36L氣體(氣體的測量均在標準狀況下),則這3. 36L氣體的質量是( )
A.6. 0gB.5. 6gC.4. 8gD.3. 8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家發現用二氧化鈦(TiO2)作催化劑可以使水在光照條件下分解制得廉價的氫氣,這使氫能源的研究和應用更向前邁進了一步。下列說法正確的是( )
A.使用二氧化鈦作催化劑使水快速分解的同時放出大量熱
B.催化劑的作用是通過改變反應的活化能來影響反應速率
C.該反應的原理是:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.每產生氫氣44.8L,轉移電子數目為4NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com