
���}Ŀ��X��Y��Z��W��R��M���NԪ�أ�λ��Ԫ�����ڱ���ǰ�����ڣ������ĺ�늺ɔ�(sh��)�����������P(gu��n)��Ϣ���£�
Ԫ�� | ���P(gu��n)��Ϣ |
X | ����|(zh��)����w������늘O���� |
Y | ԭ�Ӻ�����6�N��ͬ�\(y��n)�Ӡ�B(t��i)����� |
Z | �ǽ���Ԫ�أ����B(t��i)ԭ�ӵ�s܉������ӿ���(sh��)�cp܉������ӿ���(sh��)��ͬ |
W | ����Ԫ�أ��cZԭ�ӵăr(ji��)��Ӕ�(sh��)��ͬ |
R | �r(ji��)������Ų���3d64s2 |
M | ��B�壬����|(zh��)��������(d��o)�� |
Ո�ش����І��}(���}�r��X��Y��Z��W��R��M��������(y��ng)��Ԫ�ط�̖��ʾ)��
��1��X�Ć��|(zh��)�cZ�Ć��|(zh��)����(y��ng)�Įa(ch��n)���_____________��(��W(xu��)ʽ)��
��2��Z��W��ȣ���һ��x���^�����_____________��M2+�ĺ�������Ų�ʽ��_____________��
��3��M2Z�����c(di��n)��M2W��_____________(����������������)��Ո���ԭ��______________________��
��4��Y��Z�γɵĻ�����YZ2��VSEPRģ�͞�__________������Yԭ�����s��܉����͞�____________;N3-��YZ2���������w���tN3-�ĽY(ji��)��(g��u)ʽ��_____________��
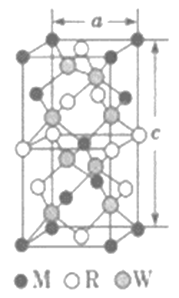
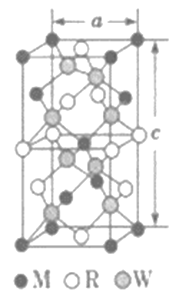
��5��MRW2�ľ�����D��ʾ����������(sh��)a=0.524nm,c=1.032nm;MRW2�ľ�����ÿ��Mԭ���c_________��Wԭ�����B�����w�ܶ���=________g��cm-3(ֻҪ������ʽ������Ӌ(j��)�����(sh��)ֵ��NA=6.02��1023mol-1)��
���𰸡� Li2O O [Ar]3d9��1s22s22p63s23p63d9 �� O2-�돽��S2-�돽С��Cu2O��Cu2S�ľ����ܴ�����Cu2O�����c(di��n)�� ֱ���� sp�s�� [N=N=N]- 4 ![]()
��������X��Y��Z��W��R��M���NԪ�أ�λ��Ԫ�����ڱ���ǰ�����ڣ������ĺ�늺ɔ�(sh��)��������Y��ԭ�Ӻ�����6����ͬ�\(y��n)�Ӡ�B(t��i)����ӣ�Y��CԪ�أ�X�Ć��|(zh��)����w��������늘O���ϣ�Xֻ�ܞ�LiԪ�أ�Z �Ƿǽ���Ԫ�أ����B(t��i)ԭ�ӵ�s܉������ӿ���(sh��)�cp܉������ӿ���(sh��)��ͬ��Z������Ų�ʽ��1s22s22p4����OԪ�أ�W������Ԫ�أ��cZspan>ԭ�ӵăr(ji��)��Ӕ�(sh��)��ͬ ��W��SԪ�أ�R �ăr(ji��)������Ų�ʽ��3d64s2��R��FeԪ�أ�Mλ�ڵ�IB�壬�䱻�Q����������I(y��)������������CuԪ����
(1)��c���ⷴ��(y��ng)��������䇣��ʴ𰸞飺Li2O��
(2)ͬһ���壬���ϵ��£���һ��x����u�pС��O��SԪ����ȣ���һ��x���^�����O��Cu2+�ĺ�������Ų�ʽ��[Ar]3d9���ʴ𰸞飺O��[Ar]3d9��
(3)���x�Ӱ돽�����x�Ӱ돽С��Cu2O��Cu2S�ľ����ܴ�����Cu2O���c(di��n)�ߣ��ʴ𰸞飺�ߣ����x�Ӱ돽�����x�Ӱ돽С��Cu2O��Cu2S�ľ����ܴ�����Cu2O���c(di��n)�ߣ�
(4)CO2�е�C����sp�s����VSEPR ģ�͞�ֱ������N3-��CO2�ǵ�����w���tN3-�ĽY(ji��)��(g��u)ʽ��[N=N=N]-���ʴ𰸞飺ֱ���ͣ� sp��[N=N=N]-��
(5)��������Cu�c2��S���B��������ÿ��Cuԭ���c4��S���B��8��S�����w��(n��i)���ɻ��W(xu��)ʽ��CuFeS2���t�������|(zh��)����![]() ����������(sh��)a=0.524nm��c=1.032nm���w�e��(0.524��10-7cm)2��1.032��10-7cm����=
����������(sh��)a=0.524nm��c=1.032nm���w�e��(0.524��10-7cm)2��1.032��10-7cm����=![]() =
=![]() =
=![]() gcm-3���ʴ𰸞飺4��
gcm-3���ʴ𰸞飺4��![]() ��
��
�c(di��n)�������}���龧��Ӌ(j��)�㼰�s���ȣ���߿���Ҋ�}�ͺ��l���c(di��n)����(c��)���ڌW(xu��)���ķ��������Ŀ��飬�������|(zh��)�Y(ji��)��(g��u)�c���|(zh��)�������Y(ji��)��(g��u)��Ӌ(j��)��Ȟ���ԓ�}���P(gu��n)�I�����}���y�c(di��n)�Ǿ�����Ӌ(j��)�㡣
���}�͡��Ɣ��}
���Y(ji��)����
12
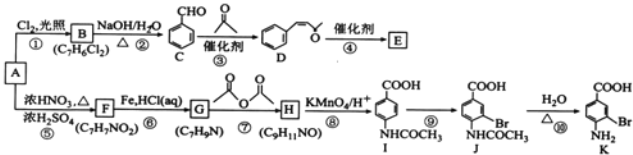
���}Ŀ������NA�ǻ����ЙC(j��)����ԭ�ϣ���A�Ƃ�߷���E���t(y��)ˎ���g�wK�ĺϳ�·��(���ַ���(y��ng)�l����ȥ)��D��ʾ��
��֪�� ;�ЙC(j��)������У�ͬһ��̼ԭ�����B���Ѓɂ��u���r����(w��n)�������Ԅ�Óˮ��
;�ЙC(j��)������У�ͬһ��̼ԭ�����B���Ѓɂ��u���r����(w��n)�������Ԅ�Óˮ��
�ش����І��}��
��1��A�����Q��_____________��K���й��܈F(tu��n)�����Q��__________________��
��2������(y��ng)����������____________________________�����ķ���(y��ng)�����____________________________��
��3����������(y��ng)���Ļ��W(xu��)����ʽ��____________________________________________________________��
��4��D�����������_____________��ԭ�ӹ�ƽ�档E�ĽY(ji��)��(g��u)��ʽ��_____________��
��5��1molD�c1molH2�ļӳɮa(ch��n)��ͬ�r�M�����Зl����ͬ�֮���(g��u)�w��_____________�N��
�����h(hu��n)��ֻ���ķN��ͬ���W(xu��)�h(hu��n)���Ě�ԭ����
�����cFeCl3�l(f��)���@ɫ����(y��ng);
��������ֻ����һ���h(hu��n)���������h(hu��n)��Y(ji��)��(g��u)��
��6������D����ʼԭ���Ƃ�![]() �ĺϳ�·���a(b��)��������
�ĺϳ�·���a(b��)��������
 _________________________(�o�C(j��)ԇ�����܄����x)���ϳ�·�����̈Dʾ�����£�CH3CHO
_________________________(�o�C(j��)ԇ�����܄����x)���ϳ�·�����̈Dʾ�����£�CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
���𰸡� �ױ� �Ȼ�����������ԭ�� ���o(h��)���� ȡ������(y��ng) ![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O 19
+2NaCl+H2O 19 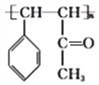 16
16 
��������������A���ڷ���N��A�cCl2���հl(f��)����(c��)���ȡ������(y��ng)����B��B�ķ���ʽ��C7H6Cl2��A�ĽY(ji��)��(g��u)��ʽ��![]() ��B�ĽY(ji��)��(g��u)��ʽ��
��B�ĽY(ji��)��(g��u)��ʽ��![]() ��D�ĽY(ji��)��(g��u)��ʽ��
��D�ĽY(ji��)��(g��u)��ʽ��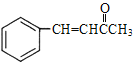 ��D�й��܈F(tu��n)��̼̼�p�I���ʻ���D���߷���E��Ӿ۷���(y��ng)��E�ĽY(ji��)��(g��u)��ʽ��
��D�й��܈F(tu��n)��̼̼�p�I���ʻ���D���߷���E��Ӿ۷���(y��ng)��E�ĽY(ji��)��(g��u)��ʽ�� ��A�c�����ᡢ������ӟ�l(f��)����������(y��ng)����F������(j��)F�ķ���ʽ�Լ�I�б��h(hu��n)�σɂ�ȡ����̎�ڌ�λ��F�ĽY(ji��)��(g��u)��ʽ��
��A�c�����ᡢ������ӟ�l(f��)����������(y��ng)����F������(j��)F�ķ���ʽ�Լ�I�б��h(hu��n)�σɂ�ȡ����̎�ڌ�λ��F�ĽY(ji��)��(g��u)��ʽ��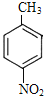 ������(j��)�}�o��֪��F�cFe/HCl��aq���l(f��)��߀ԭ����(y��ng)����G��G�ĽY(ji��)��(g��u)��ʽ��
������(j��)�}�o��֪��F�cFe/HCl��aq���l(f��)��߀ԭ����(y��ng)����G��G�ĽY(ji��)��(g��u)��ʽ��![]() ��������G��H��C9H11NO����I��I�ĽY(ji��)��(g��u)��ʽ��H�ĽY(ji��)��(g��u)��ʽ��
��������G��H��C9H11NO����I��I�ĽY(ji��)��(g��u)��ʽ��H�ĽY(ji��)��(g��u)��ʽ��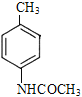 ��
��
Ԕ������1��A���ڷ���N��A�cCl2���հl(f��)����(c��)���ȡ������(y��ng)����B��B�ķ���ʽ��C7H6Cl2��A�ĽY(ji��)��(g��u)��ʽ��![]() �����Q��ױ�������(j��)K�ĽY(ji��)��(g��u)��ʽ��K���еĹ��܈F(tu��n)�����Q���Ȼ�����������ԭ�ӡ�
�����Q��ױ�������(j��)K�ĽY(ji��)��(g��u)��ʽ��K���еĹ��܈F(tu��n)�����Q���Ȼ�����������ԭ�ӡ�
��2������(y��ng)����G��-NH2�c��CH3CO��2O����(y��ng)����-NHCOCH3������(y��ng)����KMnO4/H+��H�б��h(hu��n)�ϵ�-CH3������-COOH������I��J�ĽY(ji��)��(g��u)��ʽ��I��J�鱽�h(hu��n)�ϵ��������(y��ng)��J��K��������ˮ���-NH2���ɴ˿�Ҋ������(y��ng)���������ǣ����o(h��)��������ֹ����������������(y��ng)������������ˮ�ⷴ��(y��ng)������(y��ng)��͞�ȡ������(y��ng)��
��3������(y��ng)����B��ˮ�ⷴ��(y��ng)������(y��ng)�Ļ��W(xu��)����ʽ��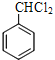 +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O��
+2NaCl+H2O��
��4��D�ĽY(ji��)��(g��u)��ʽ�� ����-CH3̼ԭ�Ӟ�sp3�s��������̼ԭ�Ӷ���sp2�s����(li��n)�뱽����ϩ��HCHO�ĽY(ji��)��(g��u)������(j��)���I�������D(zhu��n)��D�����������19��ԭ�ӹ�����6�����h(hu��n)̼ԭ�ӡ�2���p�I̼ԭ�ӡ��ʻ�̼ԭ���Լ��c����ֱ�����B��ԭ����-CH3��ֻ��1��H��ԓƽ������
����-CH3̼ԭ�Ӟ�sp3�s��������̼ԭ�Ӷ���sp2�s����(li��n)�뱽����ϩ��HCHO�ĽY(ji��)��(g��u)������(j��)���I�������D(zhu��n)��D�����������19��ԭ�ӹ�����6�����h(hu��n)̼ԭ�ӡ�2���p�I̼ԭ�ӡ��ʻ�̼ԭ���Լ��c����ֱ�����B��ԭ����-CH3��ֻ��1��H��ԓƽ������ ��
��
��5��D�ĽY(ji��)��(g��u)��ʽ�� ��D�ķ���ʽ��C10H10O��1molD�c1molH2�l(f��)���ӳɷ���(y��ng)���îa(ch��n)��ķ���ʽ��C10H12O��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w�IJ�ͶȞ�5��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w���cFeCl3�l(f��)���@ɫ����(y��ng)��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w�к����u����������ֻ����һ���h(hu��n)���������h(hu��n)��Y(ji��)��(g��u)�����h(hu��n)�����ķN��ͬ���W(xu��)�h(hu��n)����Hԭ�ӣ����h(hu��n)���Ѓɂ�ȡ�����҃ɂ�ȡ������λ���gλ���ɂ�ȡ������������r����-OH��-CH=CHCH2CH3����-OH��-CH2CH=CHCH3����-OH��-CH2CH2CH=CH2����-OH��
��D�ķ���ʽ��C10H10O��1molD�c1molH2�l(f��)���ӳɷ���(y��ng)���îa(ch��n)��ķ���ʽ��C10H12O��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w�IJ�ͶȞ�5��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w���cFeCl3�l(f��)���@ɫ����(y��ng)��ԓ�ӳɮa(ch��n)���ͬ�֮���(g��u)�w�к����u����������ֻ����һ���h(hu��n)���������h(hu��n)��Y(ji��)��(g��u)�����h(hu��n)�����ķN��ͬ���W(xu��)�h(hu��n)����Hԭ�ӣ����h(hu��n)���Ѓɂ�ȡ�����҃ɂ�ȡ������λ���gλ���ɂ�ȡ������������r����-OH��-CH=CHCH2CH3����-OH��-CH2CH=CHCH3����-OH��-CH2CH2CH=CH2����-OH��![]() ����-OH��
����-OH��![]() ����-OH��
����-OH��![]() ����-OH��
����-OH��![]() ����-OH��
����-OH��![]() �����ϗl����ͬ�֮���(g��u)�w��2
�����ϗl����ͬ�֮���(g��u)�w��2![]() 8=16�N��
8=16�N��
��6�� �cH2�l(f��)���ӳɷ���(y��ng)����
�cH2�l(f��)���ӳɷ���(y��ng)����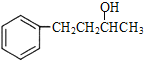 ������
������![]() �c
�c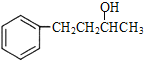 �ĽY(ji��)��(g��u)��ʽ��̼�ɹǼܛ]��׃�������܈F(tu��n)��һ���u��׃?y��u)�ɂ�̼̼�p�I������(j��)�n���ЙC(j��)��֮�g����D(zhu��n)�����ϳɲ��E����
�ĽY(ji��)��(g��u)��ʽ��̼�ɹǼܛ]��׃�������܈F(tu��n)��һ���u��׃?y��u)�ɂ�̼̼�p�I������(j��)�n���ЙC(j��)��֮�g����D(zhu��n)�����ϳɲ��E����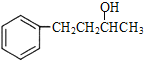 �l(f��)����ȥ����(y��ng)����
�l(f��)����ȥ����(y��ng)����![]() ��
��![]() �cBr2�l(f��)���ӳɷ���(y��ng)����
�cBr2�l(f��)���ӳɷ���(y��ng)����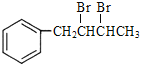 ��
��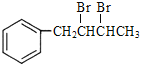 �l(f��)����ȥ����(y��ng)����
�l(f��)����ȥ����(y��ng)����![]() ���a(b��)��ĺϳ�·���飺
���a(b��)��ĺϳ�·���飺![]()
![]()
![]()
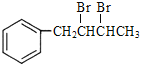
![]()
![]() ��
��


 ��������ϵ�д�
��������ϵ�д�
| �꼉 | �����n�� | �꼉 | �����n�� |
| ��һ | ��һ���M(f��i)�n�����]�� | ��һ | ��һ���M(f��i)�n�����]�� |
| �߶� | �߶����M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
| ���� | �������M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��ClO2��һ�N��������Ч�ʸߡ�������ȾС��ˮ̎�턩����(sh��)�(y��n)�ҿ�ͨ�^���·���(y��ng)�Ƶ�ClO2��2KClO3��H2C2O4��H2SO4![]() 2ClO2����K2SO4��2CO2����2H2O�������f�����_���� ��
2ClO2����K2SO4��2CO2����2H2O�������f�����_���� ��
A. 1 molKClO3���ӷ���(y��ng)��1mole- �D(zhu��n)�� B. ClO2�������a(ch��n)��
C. H2C2O4�ڷ���(y��ng)�б�߀ԭ D. KClO3�ڷ���(y��ng)�еõ���ӣ���߀ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ����500![]() ��
��![]() ��
��![]() �Ļ����Һ�ֳ�5�ȷݣ�ȡһ�ݼ��뺬
�Ļ����Һ�ֳ�5�ȷݣ�ȡһ�ݼ��뺬![]()
![]() �����c����Һ��ǡ��ʹ�^�x����ȫ��������ȡһ�ݼ��뺬
�����c����Һ��ǡ��ʹ�^�x����ȫ��������ȡһ�ݼ��뺬![]()
![]() �����y����Һ��ǡ��ʹ���x����ȫ�������tԓ�����Һ����x�ӝ�Ȟ�
�����y����Һ��ǡ��ʹ���x����ȫ�������tԓ�����Һ����x�ӝ�Ȟ�
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ���мס��҃ɂ���ȫ��ͬ���b�ã��քe�������Ă�(c��)�����b��1.06g Na2CO3��0.84g NaHCO3��ԇ���и���10mL��ͬ��ȵ��}�ᣨ��D����ͬ�r���ɂ���(c��)���е����|(zh��)ȫ��������Ե�ԇ���У����Д������_����
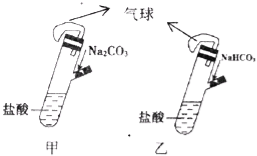
A. ���b�õĚ�����Û���ʴ�
B. ����K�ɚ����w�e��ͬ���tһ����c��HCl����2 mol/L
C. ����K�ɚ����w�e��ͬ���tһ����c��HCl����1 mol/L
D. ��K����Һ��Na+��Cl�������|(zh��)������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��NA��ʾ�����ӵ��_����(sh��)��ֵ�������f�����_����(����)
A. ��(bi��o)��(zh��n)��r�£������������ϵ�����Ͷ�����̼�����22.4 L�������ķ��Ӕ�(sh��)��NA
B. ��(bi��o)��(zh��n)��r�£�1 L����(����ʽ��C8H18)��ȫȼ���������ɚ��w�a(ch��n)��ķ��Ӕ�(sh��)��8NA/22.4
C. ��(bi��o)��(zh��n)��r�£�1 L SO3�������Ӕ�(sh��)��NA/22.4
D. ��(bi��o)��(zh��n)��r�£�������Ȼ�ϵĚ���һ����̼?x��)��w��8.96 L�������������г��ȼ���r��������ķ��Ӕ�(sh��)��0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�����}Ŀ��X��Y��Z��W��R��M���NԪ�أ�λ��Ԫ�����ڱ���ǰ�����ڣ������ĺ�늺ɔ�(sh��)�����������P(gu��n)��Ϣ���£�
Ԫ�� | ���P(gu��n)��Ϣ |
X | ����|(zh��)����w������늘O���� |
Y | ԭ�Ӻ�����6�N��ͬ�\(y��n)�Ӡ�B(t��i)����� |
Z | �ǽ���Ԫ�أ����B(t��i)ԭ�ӵ�s܉������ӿ���(sh��)�cp܉������ӿ���(sh��)��ͬ |
W | ����Ԫ�أ��cZԭ�ӵăr(ji��)��Ӕ�(sh��)��ͬ |
R | �r(ji��)������Ų���3d64s2 |
M | ��B�壬����|(zh��)��������(d��o)�� |
Ո�ش����І��}(���}�r��X��Y��Z��W��R��M��������(y��ng)��Ԫ�ط�̖��ʾ)��
��1��X�Ć��|(zh��)�cZ�Ć��|(zh��)����(y��ng)�Įa(ch��n)���_____________��(��W(xu��)ʽ)��
��2��Z��W��ȣ���һ��x���^�����_____________��M2+�ĺ�������Ų�ʽ��_____________��
��3��M2Z�����c(di��n)��M2W��_____________(����������������)��Ո���ԭ��______________________��
��4��Y��Z�γɵĻ�����YZ2��VSEPRģ�͞�__________������Yԭ�����s��܉����͞�____________;N3-��YZ2���������w���tN3-�ĽY(ji��)��(g��u)ʽ��_____________��
��5��MRW2�ľ�����D��ʾ����������(sh��)a=0.524nm,c=1.032nm;MRW2�ľ�����ÿ��Mԭ���c_________��Wԭ�����B�����w�ܶ���=________g��cm-3(ֻҪ������ʽ������Ӌ(j��)�����(sh��)ֵ��NA=6.02��1023mol-1)��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ����֪2FeSO4![]() Fe2O3+SO2��+SO3�����������P(gu��n)�������b�á�ԭ�������F(xi��n)��ı������_����
Fe2O3+SO2��+SO3�����������P(gu��n)�������b�á�ԭ�������F(xi��n)��ı������_����
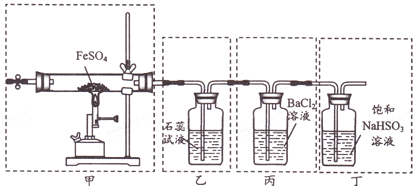
A. ���b�üߜطֽ�FeSO4���c(di��n)ȼ�ƾ�����ǰ��(y��ng)�����b�Ã�(n��i)ͨһ�Εr�gN2
B. ���b���ҿəz�(y��n)�ֽ�a(ch��n)����SO2���F(xi��n)����ʯ��ԇҺ��׃�t����ɫ
C. ���b�ñ��əz�(y��n)�ֽ�a(ch��n)����SO3���F(xi��n)���Ǯa(ch��n)����ɫ����
D. ���b�ö�������β�⣬������Ⱦ�h(hu��n)��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�������f�����_����(����)
A. �U��늳ط�늕rؓ(f��)�O�|(zh��)���p�p����늕rꖘO�|(zh��)������
B. ͬ������0.1 mol��L��1������ҺpH��a��0.01 mol��L��1������ҺpH��b���ta��1<b
C. ��Fˮ�l���à���ꖘO��ꎘO���o(h��)������������ꎘO���o(h��)���M(j��n)�з��o(h��)
D. һ���l���·���(y��ng)N2��3H2![]() 2NH3����(d��ng)3v��(H2)��2v��(NH3)���t����(y��ng)�_(d��)��ƽ��
2NH3����(d��ng)3v��(H2)��2v��(NH3)���t����(y��ng)�_(d��)��ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��ij���W(xu��)�dȤС�M�����Ƴɷ�������룺���J(r��n)��������ɼ������죻���J(r��n)��������ɽ��y�Ͻ��Ƴɣ����J(r��n)����������S�~���~�\�Ͻ�,�����(y��n)�C�����IJ��룬Ո���x��һ�Nԇ�����C���ס��ҡ�����������`: ( )
A.�����~��Һ
B.�}��
C.ϡ����
D.�����y��Һ
�鿴�𰸺ͽ���>>
���H�W(xu��)У��(y��u)�x - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_ | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com