
今有一包鐵粉和銅粉混合粉末,為確定其組成,現提供4 mol·L-1的FeCl3溶液(其它用品略),某合作學習小組同學的實驗結果如下(假定反應前后溶液體積不變):
| 組別 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末質量/g | 6 | 13.2 | 24 | 36 |
| 反應后剩余固體質量/g | 0 | 1.28 | 12.8 | 24.8 |
C
解析試題分析:根據第③④兩組反應減少的固體的質量相等,可知該條件下均是鐵把FeCl3溶液完全反應,反應鐵的質量為11.2g,物質的量為0.2mol,第④組反應后的濾液中c(Fe2+) = (0.4+0.2)÷0.1="6" mol·L-1, 第②組溶解的固體為11.92g大于11.2g,故應有銅溶解,剩余物質為未反應完全的銅,
設第②組反應的鐵和銅的物質的量分別為x、y,
根據反應方程式有2x+2y=0.4,根據質量關系為56x+64y=13.2-1.28=11.92,
聯合解為x=0.11mol,y=0.09mol所以銅的量為0.09+1.28÷64=0.11mol,鐵的物質的量為0.11mol
n(Fe)∶n(Cu) = 1∶1;
第①組反應中6g金屬中n(Fe)="n(Cu)" = 0.05mol,反應中共消耗FeCl3的量為n(FeCl3)= 2n(Fe)+2n(Cu)=0.2mol,反應后溶液中n(Fe3+) = 0.6-0.2="0.4" mol ,c(Fe3+) =" 4.0" mol·L-1
故答案為 C。
考點:考查化學計算有關問題。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:單選題
4.35 g二氧化錳能與濃鹽酸(密度為1.19 g·cm-3、質量分數為36.5%)完全反應。求:
(1)鹽酸中HCl的物質的量濃度。
(2)被氧化的HCl的物質的量。
(3)將所得氣體全部用石灰乳吸收,可得到漂白粉的質量。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列化學(或離子)方程式正確的是
A.乙酸與碳酸鈉溶液反應:2H++CO =CO2↑+H2O =CO2↑+H2O |
B.C6H6+HNO3 C6H5NO2+H2O C6H5NO2+H2O |
C.亞硫酸的電離方程式:H2SO3 2H++SO32- 2H++SO32- |
| D.醋酸溶液與新制氫氧化銅反應:CH3COOH+OH-→ CH3COO-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
設NA是阿伏加德羅常數的數值,下列說法正確的是
| A.1mol·L-1NaCl溶液含有NA個Na+ |
| B.1molCl2與足量的鐵反應,轉移的電子數為3NA |
| C.1 mol Na 與足量O2在一定條件下反應,生成Na2O和Na2O2的混合物,鈉失去NA個電子 |
| D.在酸性條件下,1molFe2+ 與足量的H2O2溶液反應,轉移2 NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有BaCl2和NaCl的混合溶液aL,將它均分成兩份。一份滴加稀硫酸,使Ba2+離子完全沉淀;另一份滴加AgNO3溶液,使Cl-離子完全沉淀。反應中消耗xmol H2SO4、ymol AgNO3。據此得知原混合溶液中的c(Na+)/ mol·L-1為
| A.(y-2x)/a, | B.(y-x)/a, | C.(2y-2x)/a, | D.(2y-4x)/a。 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
用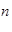 A表示阿伏加德羅常數的值。下列說法正確的是
A表示阿伏加德羅常數的值。下列說法正確的是
A.1 mol Cl-離子中含有的電子數為8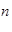 A A |
B.標準狀況下,2.24 L H20中含有的分子數為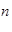 A A |
C.27g鋁與足量的氧氣反應,轉移的電子數為3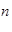 A A |
D.0.2 mo1·L-1 Ca(NO3)2溶液中含有的N03-離子數為0.4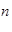 A A |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com