
【題目】某興趣小組的同學用如圖所示裝置研究有關電化學的問題。當閉合該裝置的電鍵時,觀察到檢流計的指針發生了偏轉。
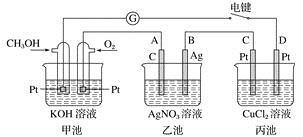
請回答下列問題:
![]() 甲池為________
甲池為________![]() 填“原電池”“電解池”或“電鍍池”
填“原電池”“電解池”或“電鍍池”![]() ,通入
,通入![]() 電極的電極反應式為__________。
電極的電極反應式為__________。
![]() 乙池中
乙池中![]() 石墨
石墨![]() 電極的名稱為________
電極的名稱為________![]() 填“正極”“負極”“陰極”或“陽極”
填“正極”“負極”“陰極”或“陽極”![]() ,總反應式為_______。
,總反應式為_______。
![]() 當乙池中B極質量增加
當乙池中B極質量增加![]() 時,甲池中理論上消耗
時,甲池中理論上消耗![]() 的體積為________
的體積為________![]() 標準狀況下
標準狀況下![]() ,丙池中________極析出________g銅。電鍵閉合一段時間后,甲中溶液的pH將________
,丙池中________極析出________g銅。電鍵閉合一段時間后,甲中溶液的pH將________![]() 填“增大”“減小”或“不變”
填“增大”“減小”或“不變”![]() 。
。
【答案】原電池 ![]() 陽極
陽極 ![]()
![]()
![]()
![]() D
D ![]() 減小
減小
【解析】
根據圖示裝置特點判斷裝置為原電池,根據燃料電池原理書寫電極反應式;根據電極反應式及電子轉移守恒進行相關計算,并判斷pH的變化。
![]() 甲池為原電池,燃料在負極失電子發生氧化還原反應在堿溶液中生成碳酸鹽,甲池中通入
甲池為原電池,燃料在負極失電子發生氧化還原反應在堿溶液中生成碳酸鹽,甲池中通入![]() 電極的電極反應為:
電極的電極反應為:![]() ;
;
![]() 乙池是電解池,A與原電池正極相連,為陽極,電池反應為:
乙池是電解池,A與原電池正極相連,為陽極,電池反應為:![]()
![]()
![]() ;
;
![]() 當乙池中B極質量增加
當乙池中B極質量增加![]() 為Ag,物質的量
為Ag,物質的量![]()
![]() ,依據電子守恒計算
,依據電子守恒計算![]() ,甲池中理論上消耗
,甲池中理論上消耗![]() 的體積
的體積![]() ;丙為電解池,C為陽極,D為陰極,電解氯化銅溶液銅離子在陰極得到電子析出銅,結合電子守恒計算
;丙為電解池,C為陽極,D為陰極,電解氯化銅溶液銅離子在陰極得到電子析出銅,結合電子守恒計算![]() ,析出銅質量
,析出銅質量![]()
![]() ;甲中甲醇與氧氣、氫氧化鉀反應生成碳酸鉀和水,反應消耗氫氧根離子,則pH減小,故答案為:280;D;
;甲中甲醇與氧氣、氫氧化鉀反應生成碳酸鉀和水,反應消耗氫氧根離子,則pH減小,故答案為:280;D;![]() ;減小。
;減小。


科目:高中化學 來源: 題型:
【題目】硫酸錳是一種重要的化工中間體,是錳行業研究的熱點。一種以高硫錳礦(主要成分為含錳化合物及FeS)為原料制備硫酸錳的工藝流程如下:

已知:①“混合焙燒”后燒渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金屬離子在水溶液中的平衡濃度與pH的關系如圖所示(25℃):

③此實驗條件下Mn2+開始沉淀的pH為7.54;離子濃度≤10-5mol·L-1時,離子沉淀完全。
請回答:
(1)傳統工藝處理高硫錳礦時,不經“混合焙燒”,而是直接用H2SO4浸出,其缺點為___________。
(2)“氧化”時,發生反應的離子方程式為_________________________________。若省略“氧化”步驟,造成的后果是_________________________________。
(3)“中和除雜”時,生成沉淀的主要成分為______________________(填化學式)。
(4)“氟化除雜”時,若使溶液中的Mg2+和Ca2+沉淀完全,需維持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化結晶”時,發生反應的離子方程式為______________________。
(6)“系列操作”指___________、過濾、洗滌、干燥
(7)用惰性電極電解MnSO4溶液可制備MnO2,電解過程中陽極的電極反應式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,降低溫度產生的影響為( )
2SO3(g) ΔH<0,降低溫度產生的影響為( )
A.v正 增大,v逆減小B.v正減小,v逆增大
C.v正和v逆同程度的增大D.v正和v逆不同等程度的減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為實驗室制取蒸餾水的裝置示意圖,根據圖示回答下列問題:

(1)指出圖中兩處明顯的錯誤:①_________________;②_________________。
(2)B儀器的名稱是______,
(3)A中除加入少量自來水外,還需加入少量沸石,其作用________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用軟錳礦漿煙氣脫硫吸收液制取電解錳,并利用陽極液制備高純碳酸錳、回收硫酸銨的工藝流程如下(軟錳礦的主要成分是MnO2,還含有硅、鐵、鋁的氧化物和少量重金屬化合物等雜質):

(1)一定溫度下,“脫硫浸錳”主要產物為MnSO4,該反應的化學方程式為______________________。
(2)“濾渣2”中主要成分的化學式為______________________。
(3)“除重金屬”時使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“電解”時用惰性電極,陽極的電極反應式為____________________________。
(5)“50℃碳化”得到高純碳酸錳,反應的離子方程式為_______________________________________。“50℃碳化”時加入過量NH4HCO3,可能的原因是______________________________________(寫兩種)。
(6)已知:25℃時,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,則該反應的平衡常數為____________________。
NH3·H2O+H+,則該反應的平衡常數為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組熱化學方程式中,化學反應的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】消除氮氧化物、二氧化硫等物質造成的污染是目前研究的重要課題。
(1)工業上常用活性炭還原一氧化氮,其反應為:2NO(g)+C(s)![]() N2(g)+CO2(g)。向容積均為lL的甲、乙、丙三個恒容恒溫容器中分別加入足量的活性炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如下表所示:
N2(g)+CO2(g)。向容積均為lL的甲、乙、丙三個恒容恒溫容器中分別加入足量的活性炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如下表所示:
t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反應溫度T℃__400℃(填“>”或“<”或“=”);
②乙容器中,0~40min內平均反應速率v(N2)=__;
③丙容器中達平衡后NO的轉化率為__。
(2)活性炭還原NO2的反應為:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒溫條件下,lmolNO2和足量活性炭發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
N2(g)+2CO2(g),在恒溫條件下,lmolNO2和足量活性炭發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:

①A、B、C三點中NO2的轉化率最高的是__點(填“A”或“B”或“C”)。
②計算C點時該反應的壓強平衡常數KP=__MPa(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)燃煤煙氣脫硫常用如下方法。
方法①:用生物質熱解氣(主要成分CO、CH4、H2)將SO2在高溫下還原成單質硫。涉及的部分反應如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
則H2(g)還原SO2(g)生成S(g)和H2O(g)的熱化學方程式為__。
方法②:用氨水將SO2轉化為NH4HSO3,再氧化成(NH4)2SO4,則用氨水將SO2轉化為NH4HSO3的離子方程式為__;實驗測得NH4HSO3溶液中![]() =15,則溶液的pH為__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=15,則溶液的pH為__。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組用如圖所示的實驗裝置探究氯氣與氨氣之間的反應。其中 A、F 為氨氣和氯氣的發生裝置,C 為純凈、干燥的氯氣與氨氣反應的裝置。
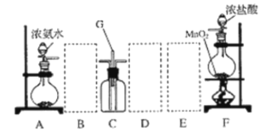
請回答下列問題:
(1)裝置 F 中發生反應的離子方程式是______________。
(2)裝置 A 中的燒瓶內固體可選用_______________(選填以下選項的代號)。
A 堿石灰 B 濃硫酸 C 生石灰 D 五氧化二磷 E 燒堿
(3)虛線框內應添加必要的除雜裝置,請從圖的備選裝置中選擇,并將編號填入下列空格:
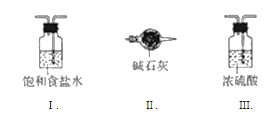
B___D____E_____
(4)氯氣和氨氣在常溫下混合就能發生反應生成氯化銨和氮氣,該反應的化學方程式為: ________;裝置 C 內出現濃厚的白煙,該物質化學式為_________。
(5)若從裝置 C 中 G 處逸出的尾氣中含有 N2 和少量 C12,應如何處理________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,下列敘述不正確的是( )

A.氣態氫化物的穩定性:H2O>NH3>SiH4
B.如圖所示實驗可證明元素的非金屬性:Cl>C>Si
C.用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
D.元素周期表中第14列非金屬元素對應的氣態氫化物沸點從上到下逐漸升高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com