
【題目】鉬酸鈉晶體(Na2MoO42H2O)是一種無公害型冷卻水系統的金屬緩蝕劑。工業上利用鉬精礦(主要成分是不溶于水的MoS2)制備鉬酸鈉的兩種途徑如圖所示:
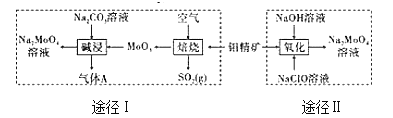
(1)途徑Ⅰ還原劑與氧化劑物質的量之比為(不考慮雜質的反應)_____;堿浸時氣體A的電子式為_______。
(2)途徑II氧化時溶液中還有Na2SO4生成,則反應的離子方程式為____。
(3)已知途徑I的鉬酸鈉溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.40mol/L。由鉬酸鈉溶液制備鉬酸鈉晶體時,需加入Ba(OH)2固體以除去CO32-。當CO32-的除去率為90%時,列式計算此時是否有BaMoO4沉淀生成____。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的體積變化]
(4)途徑II所得的BaMoO4溶液結晶后再經過重結晶可使鉬酸鈉晶體的純度提高,其利用的原理是_____。
(5)某鋰電池放電過程中,電極上發生Lix(MoS2)n與MoS2之間的轉化。則電池放電時正極的電極反應式為_____。
【答案】2:7 ![]() MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率為90%時,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不會生成BaMoO4沉淀 Na2MoO4與雜質的溶解度受溫度的影響不同 nMoS2+xLi++xe-=Lix(MoS2)n
MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率為90%時,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不會生成BaMoO4沉淀 Na2MoO4與雜質的溶解度受溫度的影響不同 nMoS2+xLi++xe-=Lix(MoS2)n
【解析】
(1)途徑I MoS2與氧氣反應生成MoO3和二氧化硫,Mo化合價由+2到+6升4,S化合價由-1到+4升5,1mol MoS2反應轉移電子14mol,而氧氣中氧元素由0價變為-2價,根據電子得失守恒可知還原劑MoS2與氧化劑O2物質的量之比為2:7;途徑I堿浸時MoO3和純堿溶液反應生成鉬酸鈉,同時得到CO2氣體,反應方程式為MoO3+Na2CO3=Na2MoO4+CO2↑;堿浸時氣體A(CO2)的電子式為![]() ;
;
(2)途徑Ⅱ用NaClO在堿性條件下氧化MoO3,得到鉬酸鈉和NaCl和水,離子反應方程式為MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)CO32-的去除率為90%時,溶液中c(CO32-)=0.04mol/L,則溶液中c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不會生成BaMoO4沉淀;
(4)途徑II所得的BaMoO4溶液結晶后再經過重結晶可使鉬酸鈉晶體的純度提高,其利用的原理是Na2MoO4與雜質的溶解度受溫度的影響不同;
(5)某鋰電池放電過程中,電極上發生Lix(MoS2)n與MoS2之間的轉化。則電池放電時正極MoS2得電子產生Lix(MoS2)n,電極反應式為nMoS2+xLi++xe-=Lix(MoS2)n。


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:
【題目】聚碳酸酯(簡稱PC)是重要的工程塑料,某種PC塑料(N)的合成路線如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反應類型是_______________。 K中含有的官能團名稱是_______________。
(2)E的名稱是_______________。
(3)④是加成反應,G的核磁共振氫譜有三種峰,G的結構簡式是__________________。
(4)⑦的化學方程式是______________________________________________。
(5)⑥中還有可能生成分子式為C9H12O2產物。分子式為C9H12O2且符合下列條件的同分異構體共有__________ 種。寫出其中兩種核磁共振氫譜有5組峰的物質的結構簡式_______________________________
a.屬于芳香化合物 ,且苯環上只有兩個取代基 b.1mol該物質能消耗1molNaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據《自然·通訊》(Nature Communications)報道,我國科學家發現了硒化銅納米催化劑在二氧化碳電化學還原法生產甲醇過程中催化效率高。銅和硒等元素化合物在生產、生活中應用廣泛。
請回答下列問題:
(1)基態硒原子的價電子排布式為________;硒所在主族元素的簡單氫化物中沸點最低的是________。
(2)電還原法制備甲醇的原理為2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①寫出該反應中由極性鍵構成的非極性分子的結構式________;
②標準狀況下,V L CO2氣體含有________個π鍵。
(3)苯分子中6個C原子,每個C原子有一個2p軌道參與形成大π鍵,可記為(π![]() 右下角“6”表示6個原子,右上角“6”表示6個共用電子)。已知某化合物的結構簡式為
右下角“6”表示6個原子,右上角“6”表示6個共用電子)。已知某化合物的結構簡式為![]() ,不能使溴的四氯化碳溶液褪色,由此推知,該分子中存在大π鍵,可表示為_______,Se的雜化方式為________。
,不能使溴的四氯化碳溶液褪色,由此推知,該分子中存在大π鍵,可表示為_______,Se的雜化方式為________。
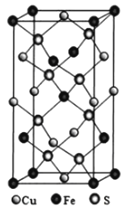
(4)黃銅礦由Cu+、Fe3+、S2-構成,其四方晶系晶胞結構如圖所示。則Cu+的配位數為________;若晶胞參數a=b=524pm,c=1032pm,用NA表示阿伏加德羅常數的值,該晶系晶體的密度是________g·cm-3(不必計算或化簡,列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有m g某氣體,它的摩爾質量為M g·mol-1。若阿伏加德羅常數用NA表示,則:
(1)該氣體的物質的量為________mol。
(2)該氣體在標況下的密度為__________g/L。
(3)該氣體在標準狀況下的體積為____________L。
(4)該氣體溶于0.1L水中(水的密度:1g·mL-1,且不考慮反應),其溶液中溶質的質量分數為_____。
(5)該氣體溶于水后形成VL溶液,其溶液的物質的量濃度為_____mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素X的單質及X與元素Y形成的化合物存在如圖所示的關系(其中m≠n,且均為正整數).下列說法正確的是( )
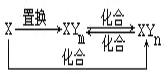
A. X一定是金屬元素
B. (n-m)一定等于1
C. 由X生成1molXYm時轉移的電子數目一定為4NA
D. 三個化合反應一定都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W是原子序數由小到大排列的五種短周期主族元素,其中X、Z、M、W四種元素的原子序數之和為32,在元素周期表中X是原子半徑最小的元素,Y原子的最外層電子數是其電子層數的2倍,Z、M左右相鄰,M、W位于同主族。回答下列問題:
(1)Y在周期表中的位置是________, W的陰離子符號是_____。
(2) Z的單質的結構式為________。標準狀況下,試管中收集滿Z的簡單氫化物后倒立于水中(假設溶質不向試管外擴散),一段時間后,試管內溶液中溶質的物質的量濃度為_______。
(3)由X、Z、M三種元素組成的化合物是酸、堿、鹽的化學式分別為________(各舉一例)。
(4)寫出加熱時Y的單質與W的最高價氧化物的水化物的濃溶液發生反應的化學方程式:____________。
(5)化合物甲由X、Z、M、W和Fe五種元素組成,甲的摩爾質量為392g·mol-1, 1 mol甲中含有6 mol結晶水。對化合物甲進行如下實驗:
a.取甲的水溶液少許,加入過量的濃NaOH溶液,加熱,產生白色絮狀沉淀和無色、有刺激性氣味的氣體;白色絮狀沉淀迅速變成灰綠色,最后變成紅褐色。
b.另取甲的水溶液少許,加入過量的BaCl2溶液,產生白色沉淀;再加鹽酸,白色沉淀不溶解。
① 甲的化學式為________。
② 已知100 mL 1 mol·L-1的甲溶液能與20 mL 1 mol·L-1的酸性KMnO4溶液恰好反應,寫出反應的離子方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求答題。
(1) 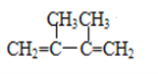 (命名)_____________________________________。
(命名)_____________________________________。
(2) 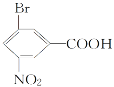 (指出所含官能團名稱)_____________________________________。
(指出所含官能團名稱)_____________________________________。
(3)寫出以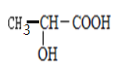 為單體發生縮聚反應的方程式________________________。
為單體發生縮聚反應的方程式________________________。
(4) 制TNT炸藥的反應________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從廢鈷酸鋰電池正極片中(含LiCoO2、Al及少量鐵、鎂的化合物等)回收鈷的工藝流程如下:
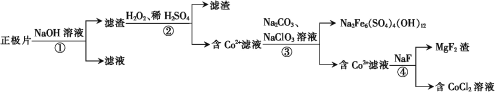
下列敘述錯誤的是
A.①中發生的離子反應為2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作還原劑
C.③中Na2CO3可用NaOH代替
D.④中除鎂反應不宜在強酸條件下進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 反應A(g)+3B(g)![]() 2C(g)+2D(g),在四種不同情況下用不同物質表示的反應速率
2C(g)+2D(g),在四種不同情況下用不同物質表示的反應速率
分別如下,其中反應速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com