
【題目】硫元素是動植物生長不可缺少的元素,廣泛存在于自然界中。
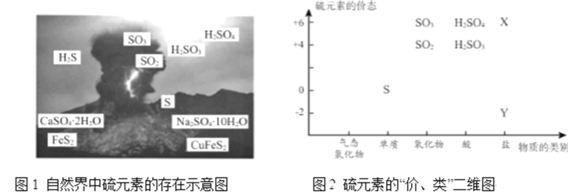
從圖1中選擇符合圖2要求的 X 、Y 代表的物質:X ______、Y ________。
(2)硫酸是重要的化工原料,小組同學對硫酸的工業制備和性質進行探究。查閱資料,工業制硫酸的過程如下:
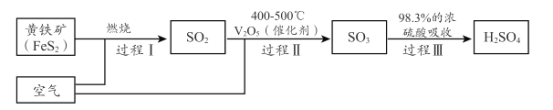
①上述工業制硫酸過程中,沒有發生氧化還原反應的過程是______________ 。(填“I ”“ II”或“III” )
②黃鐵礦( FeS2 ) 中S為- 1價,完成過程 I 的化學反應方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③過程 II 中,小組同學在 500°C 和 10l kPa 條件下,將一定量的 SO2 和 O2充入含有催化劑的密閉容器中發生反應,隨著反應的進行,用氣體傳感器測量各組分的濃度見下表
反應時間/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
數據分析,表中 a 、b 代表的數值分別是:a =________、b = _______;小 組同學判斷 SO2 和 O2的 反應 50 秒后處于平衡狀態,他們的判斷依據是___________。
(3)濃硫酸與木炭在加熱條件下可發生化學反應 ,為了檢驗反應產物,某同學設計了如下圖所示的實驗(部分夾持裝置省略)。回答相關問題
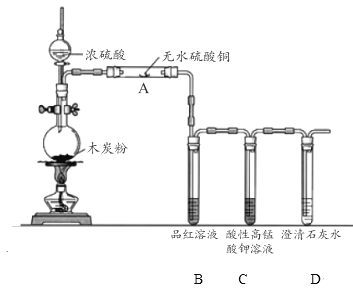
①濃硫酸與木炭反應的化學方程式是 ________________。
②裝置 A 中的實驗現象是____________;證明的產物是___________ 。
③裝置 C 的作用是_______________ 。
④該同學認為,如果去掉裝置 B 也能實現產物的驗證,該同學依據的實驗現象及推理過程是__________________。
【答案】CaSO42H2O和Na2SO410H2O CuFeS2 III 4 11O2 2 8 2.5 0.5 自50s開始SO2、SO3的濃度保持不變 ![]() 固體由白色變為藍色 H2O 除去CO2中的SO2,并檢驗是否除盡 酸性高錳酸鉀溶液既能檢驗SO2又能除去CO2中的SO2,酸性高錳酸鉀溶液顏色變淺說明產物中有SO2,而溶液未完全褪色時,說明SO2已經被除盡。
固體由白色變為藍色 H2O 除去CO2中的SO2,并檢驗是否除盡 酸性高錳酸鉀溶液既能檢驗SO2又能除去CO2中的SO2,酸性高錳酸鉀溶液顏色變淺說明產物中有SO2,而溶液未完全褪色時,說明SO2已經被除盡。
【解析】
(1)從圖2可知X、Y分別代表+6價的鹽和-2價的鹽,圖1中只有CuFeS2和CaSO42H2O、Na2SO410H2O,故答案為:CaSO42H2O和Na2SO410H2O;CuFeS2;
(2)①氧化還原反應的特征是元素的化合價發生變化,過程I 由FeS2中- 1價的S轉化為SO2中+4價的S,故是氧化還原反應,過程II是由SO2中+4價的S轉化為SO3中+6價的S,故是氧化還原反應,過程III由SO3轉化為H2SO4沒有化合價的改變,故不是氧化還原反應,答案為:III;
②根據反應前后元素種類不變發現,反應物在缺少O元素,故反應物中由O2,再黃鐵礦( FeS2 ) 中S為- 1價轉化為SO2中+4價,Fe為+2價轉化為Fe2O3中+3價,故可1molFeS2在反應中共失去11mole-,而1molO2由0價轉化為-2價,得到4mole-,根據得失電子守恒,最小公倍數為44,故FeS2前面的系數為4,氧氣的系數為11,再根據硫原子守恒可知SO2的系數為8,根據鐵原子守恒可知Fe2O3的系數為2,故答案為:4 ;11O2 ;2;8;
③根據過程II 中發生的反應進行計算: ,可知a=5-2.5=2.5,從表中可知,自50s以后SO2、SO3的濃度均不再改變,說明從50s開始反應達到化學平衡,故b=0.5,化學平衡的重要標志是正逆反應速率相等,體系各組分的濃度保持不變,故答案為:2.5; 0.5 ;自50s開始SO2、SO3的濃度保持不變;
,可知a=5-2.5=2.5,從表中可知,自50s以后SO2、SO3的濃度均不再改變,說明從50s開始反應達到化學平衡,故b=0.5,化學平衡的重要標志是正逆反應速率相等,體系各組分的濃度保持不變,故答案為:2.5; 0.5 ;自50s開始SO2、SO3的濃度保持不變;
(3) ①濃硫酸與木炭在加熱條件下生成SO2、CO2和H2O,故濃硫酸與木炭反應的化學方程式是![]() ,故答案為:
,故答案為:![]() ;
;
②裝置 A 中裝有白色的無水硫酸銅遇水會變為藍色的硫酸銅晶體(CuSO45H2O),故裝置 A 中的實驗現象是固體由白色變為藍色,證明的產物是H2O;故答案為:固體由白色變為藍色;H2O;
③裝置B是檢驗SO2的,現象為品紅溶液紅色褪去,由于CO2、SO2均能使澄清石灰水變渾濁,故需先出去SO2再檢驗CO2,故裝置 C 的作用是除去CO2中的SO2,并根據褪色情況檢驗SO2是否除盡,故答案為:除去CO2中的SO2,并檢驗是否除盡;
④CO2不能使酸性高錳酸鉀溶液褪色,而SO2可以,SO2使酸性高錳酸鉀溶液褪色的過程也使吸收SO2的過程,故酸性高錳酸鉀溶液既能檢驗SO2又能除去CO2中的SO2,故答案為:酸性高錳酸鉀溶液既能檢驗SO2又能除去CO2中的SO2,酸性高錳酸鉀溶液顏色變淺說明產物中有SO2,而溶液未完全褪色時,說明SO2已經被除盡。


科目:高中化學 來源: 題型:
【題目】下列四種有機化合物的結構簡式如下所示,均含有多個官能團,下列有關說法中正確的是( )
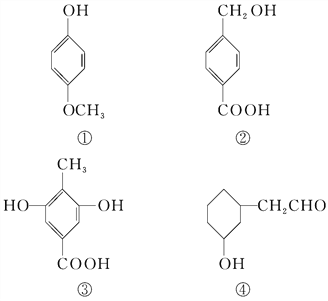
A.①屬于酚類,可與NaHCO3溶液反應產生CO2
B.②屬于酚類,能使FeCl3溶液顯紫色
C.1 mol ③最多能與3 mol Br2發生反應
D.④屬于醇類,可以發生消去反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以乙炔為主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡膠,有關合成路線圖如下:
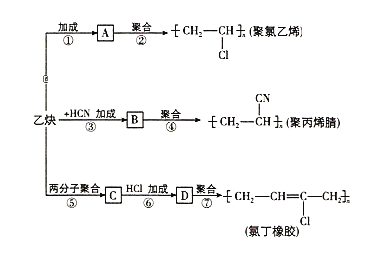
已知反應:nCH2=CH-CH=CH2![]()
![]()
請完成下列各題:
(1)寫出物質的結構簡式:A__________,C__________。
(2)寫出反應的化學方程式:
反應① :____________________;
反應③ :____________________;
反應⑦ :____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以苯為基本原料可制備X、Y、Z、W等物質,下列有關說法中正確的是( )
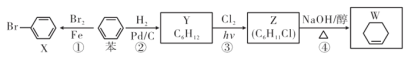
A. 反應①是苯與溴水的取代反應 B. 可用AgN03溶液檢測W中是否混有Z
C. X、苯、Y分子中六個碳原子均共平面 D. 反應④中產物除W外還有H2O和NaCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)是印染工業的一種常用原料,連二亞硫酸鈉又稱保險粉,可溶于水,但不溶于甲醇,其固體受熱、遇水都會發生反應放出大量的熱,甚至引起燃燒,工業制備流程如圖:
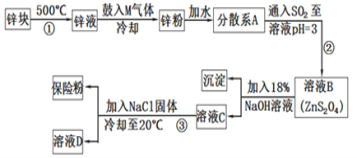
請回答下列問題:
(1)保存連二亞硫酸鈉的注意事項___(任寫一項)。
(2)鼓入的氣體M為空氣的一種主要成分,則M的電子式為___;
(3)流程②的化學方程式為__。
(4)流程③的分離方法步驟為過濾、洗滌、干燥。其中洗滌所用試劑是___;實驗時加入NaCl固體的作用是__。
(5)連二亞硫酸鈉可以用于除去廢水中的重鉻酸根離子(Cr2O72-被轉化為Cr3+,S2O42-被轉化為SO42-),寫出該反應的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錫是大名鼎鼎的“五金”-金、銀、銅、鐵、錫之一。SnCl4可用作媒染劑,可利用如下圖所示裝置可以制備SnCl4(部分夾持裝置己略去);
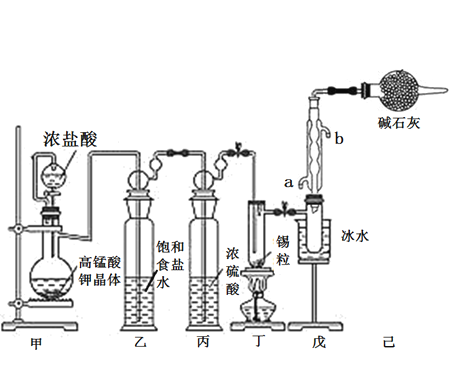
有關信息如下表:
化學式 | SnCl2 | SnCl4 |
熔點/℃ | 246 | -33 |
沸點/℃ | 652 | 144 |
其他性質 | 無色晶體,易氧化 | 無色液體,易水解 |
回答下列問題:
(1)乙中飽和食鹽水的作用為___________;戊裝置中冷凝管的進水口為________(填“a”或“b”)。
(2)甲裝置發生反應的離子方程式為________________。
(3)將裝置如圖連接好,檢查氣密性,慢慢滴入濃鹽酸,待觀察到丁裝置內充滿黃綠色氣體后,開始加熱丁裝置,錫熔化后適當增大氯氣流量,繼續加熱丁裝置,此時繼續加熱丁裝置的目的是:
①促進氯氣與錫反應;
②__________________。
(4)己裝置的作用是_______________。
(5)某同學認為丁裝置中的反應可能產生SnCl2雜質,以下試劑中可用于檢測是否產生SnCl2的有__________(填標號)。
A.FeCl3溶液(滴有幾滴KSCN溶液) B.溴水 C.AgNO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的圖示及分析均正確的是( )
選項 | 實驗目的 | 實驗圖示 | 實驗分析 |
A | 催化裂解正戊烷并收集產物 |
| 正戊烷裂解為分子較小的烷烴和烯烴 |
B | 石蠟油的分解并檢驗產物 |
| 石蠟油分解的 產物含有不飽和烴 |
C | 制取并收集乙炔 |
| 用飽和食鹽水代替純水,可達到降低反應速率的目的 |
D | 實驗室制硝基苯 |
| 反應完全后,可用儀器a、b蒸餾提純產品 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一種化合物是很多表面涂層的重要成分,其結構如圖所示,其中W、X、Y、Z為原子序數依次增大的短周期主族元素,只有X、Y在同一周期,Y無最高正價,Z的含氧酸均具有氧化性,下列有關說法正確的是( )

A.WZ沸點高于W2Y的沸點
B.含Z的兩種酸反應可制得Z的單質
C.W2Y2中既含離子鍵又含共價鍵
D.X的含氧酸一定為二元弱酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列9種微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各題:
。按要求完成以下各題:
(1)![]() 、
、![]() 分別是氫元素的一種______,它們互為______。
分別是氫元素的一種______,它們互為______。
(2)互為同素異形體的微粒是______。
(3)![]() 的中子數為______,核外電子數為______。
的中子數為______,核外電子數為______。
(4)形成上述9種微粒的核素有______種、元素有______種。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com