
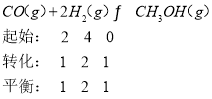
【題目】若反應 CO(g)+2H2(g)![]() CH3OH(g)在溫度不變且體積恒定為1的密閉容器中發生,反應過程中各物質的物質的量隨時間變化如表所示:
CH3OH(g)在溫度不變且體積恒定為1的密閉容器中發生,反應過程中各物質的物質的量隨時間變化如表所示:
時間/min | 0 | 5 | 10 | 15 |
H2 | 4mol | 2mol | ||
CO | 2mol | 1mol | ||
CH3OH(g) | 0 | 0.7mol |
①下列各項能作為判斷該反應達到平衡標志的是____________(填字母);
A.容器內壓強保持不變
B.2v正(H2)=v逆(CH3OH)
C.混合氣體的相對分子質量保持不變
D.混合氣體的密度保持不變
②若起始壓強為P0 kPa,則在該溫度下反應的平衡常數Kp=_________ (kPa)-2(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③反應速率若用單位時間內分壓的變化表示,則10min內H2的反應速率v(H2)=__________kPamin-1。
【答案】AC ![]()
![]()
【解析】
結合平衡的特征“等、定”及衍生的物理量判定平衡狀態;K為生成物平衡分壓冪之積與反應物平衡分壓冪之積的比值;結合v=![]() 計算。
計算。
①A、容器內壓強保持不變,可知氣體的總物質的量不變,為平衡狀態,故A選;
B、2v正(H2)=v逆(CH3OH),不滿足不同物質的正逆反應速率之比等于化學計量數之比,不是平衡狀態,故B不選;
C、混合氣體的相對分子質量保持不變,可知氣體的總物質的量不變,為平衡狀態,故C選;
D、混合氣體的密度始終保持不變,不能以此判斷平衡狀態,故D不選。
故答案為:AC;
②由表中數據可知,10min達到平衡,則
由于反應開始時氣體的物質的量是6mol,起始壓強為P0,平衡時的壓強為![]() P0,反應開始氫氣的分壓為
P0,反應開始氫氣的分壓為![]() P0,平衡時氫氣的分壓為
P0,平衡時氫氣的分壓為![]() P0×
P0×![]() =
=![]() P0,CO、CH3OH的平衡分壓均為
P0,CO、CH3OH的平衡分壓均為![]() P0×
P0×![]() =
=![]() P0,
P0,
若起始壓強為P0 kPa,則在該溫度下反應的平衡常數Kp=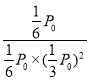 (kPa)-2=
(kPa)-2=![]() (kPa)-2,故答案為:
(kPa)-2,故答案為:![]() ;
;
③10min內H2的反應速率v(H2)=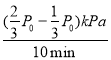 =
=![]() kPamin-1,故答案為:
kPamin-1,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】![]() 環境科學
環境科學![]() 刊發了我國科研部門采用零價鐵活化過硫酸鈉
刊發了我國科研部門采用零價鐵活化過硫酸鈉![]() ,其中S為
,其中S為![]() 價
價![]() 去除廢水中的正五價砷
去除廢水中的正五價砷![]() 的研究成果,其反應機制模型如圖所示。設阿伏加德羅常數的值為
的研究成果,其反應機制模型如圖所示。設阿伏加德羅常數的值為![]() ,
,![]() 。下列敘述正確的是
。下列敘述正確的是![]()
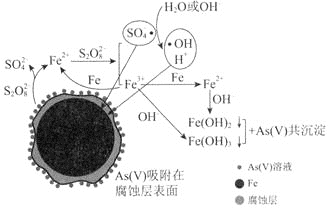
A.![]() 過硫酸鈉
過硫酸鈉![]() 含
含![]() 個過氧鍵
個過氧鍵
B.若![]() 參加反應,共有
參加反應,共有![]() 個
個![]() 被還原
被還原
C.室溫下,中間產物![]() 溶于水所得飽和溶液中
溶于水所得飽和溶液中![]() 為
為![]()
D.pH越小,越有利于去除廢水中的正五價砷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在一定條件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密閉容器中加入2molSO2和1molO2,達平衡時SO2的轉化率為90%,放出的熱量為Q1;向另一相同容器中加入2molSO3,在相同條件下,達平衡時吸收的熱量為Q2,則下列關系中正確的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密閉容器中加入2molSO2和1molO2,達平衡時SO2的轉化率為90%,放出的熱量為Q1;向另一相同容器中加入2molSO3,在相同條件下,達平衡時吸收的熱量為Q2,則下列關系中正確的是( )
A. Q>Q1>Q2B. Q2>Q>Q1C. Q1>Q>Q2D. Q>Q1=Q2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中A、B、C、D、E、F、G均為有機化合物。

根據上圖回答問題:
(1)D、F的化學名稱是_______________、_________________。
(2)寫出下列反應的化學方程式,并注明反應類型。
②__________,_______________;
④_________,________________。
(3)A的結構簡式是_____________,1 mol A與足量的NaOH溶液反應會消耗_____________mol NaOH。
(4)符合下列3個條件的B的同分異構體的數目有__________個。
①含有鄰二取代苯環結構
②與B有相同官能團
③不與FeCl3溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相對位置如圖![]() 甲不一定在丁、庚的連線上
甲不一定在丁、庚的連線上![]() ,戊、己分別是空氣、地殼中含量最多的元素.下列判斷正確的是
,戊、己分別是空氣、地殼中含量最多的元素.下列判斷正確的是

A.甲與己形成的化合物一定是離子化合物
B.簡單氣態氫化物的穩定性:庚![]() 己
己![]() 戊
戊
C.乙、丙、丁的最高價氧化物水化物可以相互反應
D.庚的最高價氧化物水化物酸性最強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.己烷共有4種同分異構體,它們的熔點、沸點各不相同
B.用溴水即可鑒別苯酚溶液、2,4-己二烯和甲苯
C.有機物 的名稱是2,3,5,5-四甲基-4-乙基己烷
的名稱是2,3,5,5-四甲基-4-乙基己烷
D.![]() 的名稱:2-乙基丙烷
的名稱:2-乙基丙烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右表為元素周期表的一部分,其中X、Y、Z、W為短周期元素,Z元素的核電荷數為X與Y元素核電荷數之和。下列說法正確的是

A.氫化物穩定性Y比W強,是因為Y的氫化物中存在氫鍵
B.XY2、XW2、ZY2熔沸點依次增大,都是由共價鍵形成的分子晶體
C.一定條件下,X單質能與ZY2反應生成Z單質,說明X的非金屬性比Z強
D.根據元素周期律,可以推測T元素的單質具有半導體特性,鈉能與T形成Na2T2化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組熱化學方程式中,化學反應的ΔH前者大于后者的是 ( )
A.C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH3 S(l)+O2(g)=SO2(g) ΔH4
C. 2H2(g)+O2(g)=2H2O(l) ΔH5 H2(g)+![]() O2(g)=H2O(l) ΔH6
O2(g)=H2O(l) ΔH6
D.CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究小組設計用含氯的有機物A合成棉織物免燙抗皺整理劑M的路線如下(部分反應試劑和條件未注明):

已知:①E的分子式為C5H8O4,能發生水解反應,核磁共振氫譜顯示E分子內有2種不同化學環境的氫原子,其個數比為3∶1;

(R、R′、R″代表相同或不相同的烴基)。
(1)A分子中的含氧官能團的名稱是________________。
(2)D→E反應的化學方程式是____________。
(3)A→B反應所需的試劑是________________。
(4)G→H反應的化學方程式是____________。
(5)已知1 mol E與2 mol J反應生成1 mol M,則M的結構簡式是________。
(6)E的同分異構體有下列性質:①能與NaHCO3反應生成CO2;②能發生水解反應,且水解產物之一能發生銀鏡反應,則該同分異構體共有________種,其中任意1種的結構簡式是________。
(7)J可合成高分子化合物,該高分子化合物的結構簡式是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com