
【選修3-物質的結構與性質】(15分)
上表為周期表的一部分,其中的編號代表所對應的元素。請回答下列問題:
(1)⑨號元素的基態原子的價電子排布式是________,與其同周期,且基態原子的核外未成對電子數最多的元素是______(寫出元素符號),②號元素基態原子的電子排布圖為___。
(2) ①號與③號元素形成的含有18電子的物質為________(寫出名稱),②號與③號元素形成的,能造成溫室效應的物質的空間構型為________。
②、④、⑧三種元素的原子形成的晶體,其晶胞的結構特點如圖所示,則該化合物的化學式為________(用對應的元素符號表示),常溫條件下丙烯是氣態,而相對分子質量比丙烯小的甲醇,常溫條件下卻呈液態,出現這種現象的原因是____________。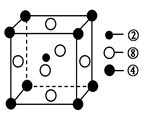
(3)①、②兩種元素能形成多種平面形分子,其中有一種相對分子質量最小,有關該分子的說法中正確的是________。
a.該分子屬于含有極性鍵的非極性分子b.該分子含有4個σ鍵和1個π鍵
c.該分子中的②原子采取sp2雜化d.該物質易溶于水,并能和水反應得到酒精
(4)某元素的價電子排布式為nsnnpn+1,該元素可與元素①形成含有10個電子的分子X,將過量的X通入盛有硫酸銅溶液的試管里,產生的現象為_______。
(5) 若D元素與Fe元素形成某種晶體如圖所示。若晶胞的邊長為a nm,則合金的密度為________g/cm3。
(1) 3d104s1 (1分) Cr (1分) 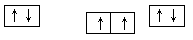
(1分)
(2) 過氧化氫 (1分) 直線型 (1分) MgNi3C或Ni3MgC (2分)
甲醇分子間存在氫鍵,而丙烯分子間只有范德華力 (2分)
(3)ac (2分)
(4)先產生藍色沉淀,后沉淀消失,溶液變成深藍色 (2分)
(5 ) 0.92/a3或5.56×1023/(a3NA) (2分)
解析試題分析:(1)⑨號元素為銅元素,基態原子的價電子排布式是3d104s1,與其同周期,且基態原子的核外未成對電子數最多的元素的電子排布式為[Ar]3d54s1是Cr,②號元素為碳元素,基態原子的電子排布圖 
(2) ①號元素氫與③號元素氧形成的含有18電子的物質為過氧化氫,②號元素碳與③號元 素氧形成的,能造成溫室效應的物質二氧化碳的空間構型為直線型。根據晶胞的結構利用切割法判斷,1個晶胞中含有1個碳原子,鎂原子8×1/8=1個,鎳原子6×1/2=3個,C、Mg、Ni三種元素的原子形成的晶體的化學式為MgNi3C或Ni3MgC,常溫條件下丙烯是氣態,而相對分子質量比丙烯小的甲醇,常溫條件下卻呈液態,出現這種現象的原因是甲醇分子間存在氫鍵,而丙烯分子間只有范德華力。
(3)C、H兩種元素能形成多種平面形分子,其中有一種相對分子質量最小為 乙炔,a.該分子中碳氫鍵為極性鍵,分子結構對稱,屬于含有極性鍵的非極性分子,正確;b.該分子含有2個碳氫鍵和1個碳碳三鍵,共3個σ鍵和2個π鍵,錯誤;c.該分子為直線型,碳原子采取sp1雜化,錯誤;d、該物質微溶于水,錯誤,選a;
(4)某元素的價電子排布式為nsnnpn+1,該元素為氮元素,可與元素氫形成含有10個電子的分子氨氣,將過量的氨氣通入盛有硫酸銅溶液的試管里,先發生復分解反應后發生絡合反應,產生的現象為先產生藍色沉淀,后沉淀消失,溶液變成深藍色。
(5) 根據晶胞的結構先確定1個晶胞中含有各原子的個數,進一步確定化學式,結合密度的定義及相關數學知識進行計算。無法確定D元素,無法計算
考點:考查元素周期表的結構、核外電子排布規律、晶體結構與性質。


科目:高中化學 來源: 題型:填空題
(1)非金屬單質A是實驗室里常用的惰性電極材料,A元素原子基態時的電子排布圖為 。
(2)B原子基態時2p原子軌道上有3個未成對電子,下列敘述正確的是 (填字母序號)
a.B的氣態氫化物的沸點在同族元素的氫化物中最低
b.B的第一電離能、電負性都比A的大
c.A的氣態氫化物比B的氣態氫化物穩定
d.A的含氧酸一定比B的含氧酸酸性強
(3)銅單質及其化合物在很多領域有重要的用途,如超細銅粉可應用于導電材料、催化劑等領域中。超細銅粉的某制備方法如下:
①[Cu(NH3)4]SO4中,N、O、S三種元素的第一電離能從小到大的順序為: 。
②SO42-空間構型是 。 寫出一種與SO32-互為等電子體的分子 。
③NH4CuSO3中的金屬陽離子的結構示意圖為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X~R是元素周期表中的短周期元素,其性質或結構信息如下表:
| 元素 | X | Y | Z | W | R |
| 性質信息 | 能形成+7價的化合物 | 日常生活中常見金屬,熔化時并不滴落,好象有一層膜兜著 | 通常狀況下能形成短周期中最穩定的雙原子分子 | 焰色反應為黃色 | 位于第IVA,是形成化合物種類最多的元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表是元素周期表的一部分,根據表中10種元素,用元素符號或化學式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | | ② | | |
| 3 | | | ③ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | ⑨ | ⑧ | | | | ⑩ | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D、E都為短周期元素,A是相對原子質量最小的元素;B的+1價陽離子和C的―1價陰離子都與氖原子具有相同的電子層結構;D在C的下一周期,可與B形成BD型離子化合物;E和C為同一周期元素,其最高價氧化物對應的水化物為一種強酸。請根據以上信息回答下列問題。
(1)B元素在元素周期表中的位置是 ____________族。
(2)畫出D元素的原子結構示意圖____________。
(3)與E的氫化物分子所含電子總數相等的分子是____________(舉一例、填化學式),離子是____________(舉一例、填電子式)。
(4)A與C形成的化合物中含有的化學鍵的類型是____________。
(5)D的單質與B的最高價氧化物對應的水化物的溶液發生反應的離子方程式是__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)元素周期表是學習化學的重要工具,它隱含著許多信息和規律,下面是八種短周期元素的相關信息(已知鈹的原子半徑為0.089nm)
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合價 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
【物質結構與性質】
根據元素周期表中第四周期元素的相關知識,回答下列問題:
(1)第四周期元素的基態原子的電子排布中4s軌道上只有1個電子的元素有________種;寫出Cu+的核外電子排布式________。
(2)按電子排布,可將周期表里的元素劃分成五個區域,第四周期元素中屬于s區的元素有________種,屬于d區的元素有________種。
(3)CaO晶胞如所示,CaO晶體中Ca2+的配位數為 ;CaO的焰色反應為磚紅色,許多金屬或它們的化
合物都可以發生焰色反應,其原因是_______。
(4)由疊氮化鉀(KN3)熱分解可得純N2:2KN3(s)=2K(l)+3N2(g),下列有關說法正確的是_______(填選項字母)。
A NaN3與KN3結構類似,前者晶格能較小
B晶體鉀的晶胞結構如圖所示: ,每個晶胞中分攤2個鉀原子
,每個晶胞中分攤2個鉀原子
C氮的第一電離能大于氧
D氮氣常溫下很穩定,是因為氮的電負性小
(5)二氧化鈦(TiO2)是常用的、具有較高催化活性和穩定性的光催化劑。O2在其催化作用下,可將CN-氧化成CNO-。CN-的電子式為_______,CNO-的中心原子的雜化方式為______。
(6)在CrCl3溶液中,一定條件下存在組成為[CrCln(H2O)6-n]x+ (n和x均為正整數)的配離子,將其通過氫離子交換樹脂(R-H),可發生離子交換反應:
[CrCln(H2O)6-n]X++ xR- Rx[CrCln(H2O)6-n]+xH+。將含0.0015 mol[CrCln(H2O)6-n]x+的溶液,與R-H完全交換后,中和生成的H+需濃度為0.1200 mol·L-1NaOH溶液25.00 mL,則該配離子的化學式為_______。
Rx[CrCln(H2O)6-n]+xH+。將含0.0015 mol[CrCln(H2O)6-n]x+的溶液,與R-H完全交換后,中和生成的H+需濃度為0.1200 mol·L-1NaOH溶液25.00 mL,則該配離子的化學式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
、I.德國和美國科學家首先制出由20個碳原子組成的空心籠狀分子C20,該籠狀結構是由許多正五邊形構成如圖。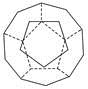
①C20分子中每個碳原子只跟相鄰的3個碳原子形成化學鍵;
②多面體的頂點數、面數和棱邊數的關系,遵循歐拉定理:頂點數+面數+棱邊數=2,
請回答: C20分子共有________個正五邊形,共有________條棱邊。
II.A、B、C是短周期非金屬元素,核電荷數依次增大。A原子外圍電子排布為ns2np2,C是地殼中含量最多的元素。D元素的核電荷數為29。請用對應的元素符號或化學式填空:
(1)A、B、C的第一電離能由小到大的順序為________。
(2)分子(AB)2中鍵與鍵之間的夾角為180°,并有對稱性,每個原子最外層電子數均滿足八電子,其結構式為________,1 mol該分子中含有π鍵的數目為________。該分子中碳原子的雜化軌道類型是__________________,該分子屬于________分子(填“極性”或“非極性”)。
(3)基態D原子的電子排布式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(每空1分,共8分) 實驗探究:探究碳、硅元素的非金屬性的相對強弱。根據要求完成下列各小題
填寫所示儀器名稱A B
(2)實驗步驟:
連接儀器、_____________、加藥品后,打開a、然后滴入濃硫酸,加熱
(3)問題探究:(已知酸性強弱:亞硫酸 >碳酸)
①銅與濃硫酸反應的化學方程式是 ;裝置E中足量酸性KMnO4溶液的作用是 ;
②能說明碳元素的非金屬性比硅元素非金屬性強的實驗現象是 ;
③依據試管D中的實驗現象,能否證明硫元素的非金屬性強于碳元素的非金屬性___(填“能”或“否”),試管D中發生反應的離子方程式是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com