
【題目】甲、乙兩個實驗小組利用KMnO4酸性溶液與H2C2O4溶液反應研究影響反應速率的因素。
(1)該反應的離子方程式為__________________________。
設計實驗方案如下(實驗中所用KMnO4溶液均已加入H2SO4):
(2)甲組:通過測定單位時間內生成CO2氣體體積的大小來比較化學反應速率的大小。實驗裝置如圖,實驗時分液漏斗中A溶液一次性放下,A、B的成分見下表:

序號 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
該實驗探究的是______對化學反應速率的影響。在反應停止之前,相同時間內針管中所得CO2的體積由大到小的順序是____________(用實驗序號填空)。
(3)乙組:通過測定KMnO4溶液褪色所需時間的多少來比較化學反應速率的大小。取兩支試管各加入2 mL 0.1 mol/L H2C2O4溶液,另取兩支試管各加入4 mL 0.1 mol/L KMnO4溶液。將四支試管分成兩組(各有一支盛有H2C2O4溶液和KMnO4溶液的試管),一組放入冷水中,另一組放入熱水中,經過一段時間后,分別混合并振蕩,記錄溶液褪色所需時間。該實驗目的是研究_________對化學反應速率的影響,但該組同學始終沒有看到溶液褪色,其原因是____________。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 濃度和催化劑 ③>②>① 溫度 沒有加入稀硫酸酸化或高錳酸鉀過量導致
【解析】
(1)高錳酸鉀具有氧化性,草酸具有還原性,二者會發生氧化還原反應,根據電子守恒、電荷守恒及原子守恒,可得反應的離子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)根據表格數據可知①②是探究濃度對化學反應速率的影響;②③是探究催化劑對化學反應速率的影響;在其它條件不變時,增大反應物的濃度,化學反應速率加快;在其它條件不變時,使用催化劑,可以成千上萬倍的增大反應速率,速率越快,相同時間產生的氣體就越多,所以在反應停止之前,相同時間內針管中所得CO2的體積由大到小的順序是③>②>①;
(3)將四支試管分成兩組(各有一支盛有H2C2O4溶液和KMnO4溶液的試管),一組放入冷水中,另一組放入熱水中,經過一段時間后,分別混合并振蕩,記錄溶液褪色所需時間。該實驗目的是研究溫度對化學反應速率的影響;草酸和高錳酸鉀反應的方程式為:2MnO4-+5H2C2O4+6H+ =2Mn2++ 10CO2↑+ 8H2O,草酸的物質的量為:n(H2C2O4)=0.002L×0.1mol/L=2×10-4mol,高錳酸鉀的物質的量為:n(KMnO4)=0.004L×0.1mol/L=4×10-4 mol,由方程式中二者反應的物質的量關系可知,高錳酸鉀過量或沒有加入稀硫酸酸化,故沒看到溶液完全褪色。


科目:高中化學 來源: 題型:
【題目】為了減輕大氣污染,可在汽車尾氣排放處加裝“催化凈化器”裝置。
(1)通過“催化凈化器”的CO、NO在催化劑和高溫作用下可發生可逆反應,轉化為參與大氣循環的無毒混合氣體,寫出該反應的化學方程式:__。
(2)在一定溫度下,向1L密閉恒容容器中充入1molNO、2molCO,發生上述反應,10s時反應達到平衡,此時CO的物質的量為1.2mol。請回答下列問題:
①前10s內平均反應速率v(CO)=___。
②在該溫度下反應的平衡常數K=___。
③關于上述反應,下列敘述正確的是___(填字母)。
A.達到平衡時,移走部分CO2,平衡將向右移動,正反應速率加快
B.擴大容器的體積,平衡將向右移動
C.在相同的條件下,若使用甲催化劑能使正反應速率加快105倍,使用乙催化劑能使逆反應速率加快108倍,則應該選用乙催化劑
D.若保持平衡時的溫度不變,再向容器中充入0.8molCO和0.4molN2,則此時v正>v逆
④已知上述實驗中,c(CO)與反應時間t變化曲線Ⅰ如圖:

若其他條件不變,將1molNO、2molCO投入2L容器進行反應,請在圖中繪出c(CO)與反應時間t1變化曲線Ⅱ___(不要求標出CO的終點坐標)。
(3)測試某汽車冷啟動時的尾氣催化處理,CO、NO百分含量隨時間變化曲線如圖:

請回答:
前0~10s階段,CO、NO百分含量沒明顯變化的原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni﹣Cd)可充電電池在現代生活中有廣泛應用。電解質溶液為KOH溶液,電池反應為:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有關鎳鎘電池的說法正確的是( )
Cd(OH)2+2Ni(OH)2,下列有關鎳鎘電池的說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.充電時陽極反應為Cd(OH)2+2e-=Cd+2OH-
C.放電時電池內部OH-向負極移動
D.充電時與直流電源負極相連的電極上發生Ni(OH)2轉化為NiO(OH)的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2molSO2和1molO2混合置于體積可變,壓強恒定的密閉容器中,在一定溫度下發生如下反應:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,當反應進行到時間t1點時達到平衡狀態,測得混合氣體總物質的量為2.1mol。試回答下列問題:
2SO3(g);△H<0,當反應進行到時間t1點時達到平衡狀態,測得混合氣體總物質的量為2.1mol。試回答下列問題:
(1)反應進行到t1時,SO2的體積分數為__;
(2)若在t1時充入一定量的氬氣(Ar),SO2的物質的量將__(填“增大”、“減小”或“不變”);
(3)若在t1時升溫,重新達到平衡狀態,新平衡混合物中氣體的總物質的量_2.1mol(填“<”、“>”或“=”),簡單說明原因:__。
(4)若t1達到平衡后,保持容器的體積不再變化。再加入0.2molSO2、0.1molO2和1.8molSO3,此時v逆_v正(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】慶祝新中國成立 70 周年閱兵式上,“東風-41 洲際彈道導彈”“殲 20”等護國重器閃耀亮相,它們都采用了大量合金材料。
回答下列問題:
(1)某些導彈的外殼是以碳纖維為增強體,金屬鈦為基體的復合材料。基態鈦原子的外圍電子排布式為_____。鈦可與 C、N、O 等元素形成二元化合物,C、N、O 元素的電負性由大到小的順序是_________。
(2)鈦比鋼輕,比鋁硬,鈦硬度比鋁大的原因是_____。
(3)鈦鎳合金可用于戰斗機的油壓系統,該合金溶于熱的硫酸生成 Ti(SO4)2、NiSO4,其中陰離子的立體構型為_____,S 的_____雜化軌道與 O 的 2p 軌道形成_____鍵(填 “π”或“σ”)。
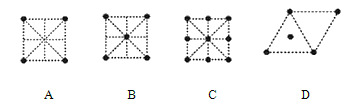
(4)金屬鈦采用六方最密堆積的方式形成晶體,其晶胞的俯視圖為_____(填字母序號)。
(5)氮化鈦熔點高,硬度大,其晶胞結構如圖所示。
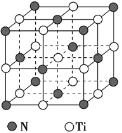
若氮化鈦晶體中 Ti 原子的半徑為 a pm,N 原子的半徑為 b pm,則氮化鈦晶體中原子的空間利用率的計算式為_____(用含 a、b 的式子表示)。碳氮化鈦化合物在航天航空領域有廣泛的應用,其結構是用碳原子代替氮化鈦晶胞頂點的氮原子,則這種碳氮化鈦化合物的化學式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由CH3CH2CH2Br制備CH3CH(OH)CH2OH,依次發生的反應類型和反應條件都正確的是
選項 | 反應類型 | 反應條件 |
A | 加成、取代、消去 | KOH醇溶液/加熱、KOH水溶液/加熱、常溫 |
B | 消去、加成、取代 | NaOH醇溶液/加熱、常溫、KOH水溶液/加熱 |
C | 氧化、取代、消去 | 加熱、KOH醇溶液/加熱、KOH水溶液/加熱 |
D | 消去、加成、水解 | NaOH水溶液/加熱、常溫、NaOH醇溶液/加熱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下將NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述錯誤的是

A. Ka2(H2X)的數量級為10-6
B. 曲線N表示pH與 的變化關系
的變化關系
C. NaHX溶液中c(H+)>c(OH-)
D. 當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中成藥連花清瘟膠囊在對抗 H1N1病毒中發揮重大作用,其有效成分綠原酸的結構簡式如圖,下列有關說法錯誤的是

A. 綠原酸屬于芳香族化合物
B. 分子中至少有 7 個碳原子共面
C. 1mol 綠原酸最多可消耗 5mol NaOH
D. 與綠原酸苯環上取代基種類及個數均相同的有機物有5 種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學家們合成了一種新物質——五星烷,其鍵線式如圖所示。下列有關五星烷的說法正確的是( )

A. 五星烷與乙烷互為同系物 B. 五星烷的化學式為C15H20
C. 五星烷的分子中含有7個五元環 D. 五星烷的一氯代物有3種
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com