
(15分)四種主族元素的性質或結構信息如下:
| 元素編號 | 相關信息 |
| X | 地殼中含量最大的金屬元素;元素最高價為+3價。 |
| Y | 原子最外層電子數是電子層數的2倍,最外層電子數是X最外層電子數的2倍。 |
| Z | 同周期主族元素中原子半徑最小,常溫下單質呈液態。 |
| M | 能從海水中提取的金屬元素,單質可在氮氣或二氧化碳中燃燒。 |

(1)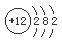 ; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
; Mg(OH)2;(2)SO2(3)S2- + Br2 =" S" + 2Br-
4)B C E (5)正極 溶液逐漸變成淺綠色。
解析試題分析:根據題意可知:X是Al;Y是S;Z是Br;M是Mg。(1)Mg的原子結構示意圖是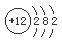 ;在上述元素中金屬性最強的元素是Mg,其最高價氧化物對應的水化物堿性最強,化學式是Mg(OH)2;(2)(2)S單質溶于熱濃的硫酸發生反應: S+2H2SO4(濃)△3SO2↑+2H2O產生的氣體的化學式為SO2,(3)活動性強的能把活動性弱的從化合物中置換出來。能體現Z單質比Y單質活潑性強的一個化學方程式:Na2S+ Br2 =" S↓+" 2NaBr;離子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.錯誤。B.Fe2O3與Al發生反應要在高溫條件下,在常溫不能反應。正確。C.在常溫下Al遇濃硫酸會發生鈍化,使反應不能在進行。正確。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.錯誤。E.Na2CO3固體與Al不能發生反應。正確。因此選項為B C E。(5)用惰性電極電解FeBr3溶液。由于陰離子的放電能力Br->OH-,所以在與電源的正極相連接的陽極碳棒上發生反應:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油顏色將變深,在陰極碳棒上發生反應:2Fe3++2e-=2Fe2+;附近的水溶液由黃色溶液逐漸變成淺綠色。
;在上述元素中金屬性最強的元素是Mg,其最高價氧化物對應的水化物堿性最強,化學式是Mg(OH)2;(2)(2)S單質溶于熱濃的硫酸發生反應: S+2H2SO4(濃)△3SO2↑+2H2O產生的氣體的化學式為SO2,(3)活動性強的能把活動性弱的從化合物中置換出來。能體現Z單質比Y單質活潑性強的一個化學方程式:Na2S+ Br2 =" S↓+" 2NaBr;離子方程式是S2- + Br2 =" S" ↓+ 2Br-。(4)A.Al+ 3CuSO4= 3Cu+Al2(SO4)3.錯誤。B.Fe2O3與Al發生反應要在高溫條件下,在常溫不能反應。正確。C.在常溫下Al遇濃硫酸會發生鈍化,使反應不能在進行。正確。D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑.錯誤。E.Na2CO3固體與Al不能發生反應。正確。因此選項為B C E。(5)用惰性電極電解FeBr3溶液。由于陰離子的放電能力Br->OH-,所以在與電源的正極相連接的陽極碳棒上發生反應:2Br--2e-=Br2. Br2容易溶解在煤油中,所以煤油顏色將變深,在陰極碳棒上發生反應:2Fe3++2e-=2Fe2+;附近的水溶液由黃色溶液逐漸變成淺綠色。
考點:考查元素的推斷、性質、原子結構示意圖、離子方程式的書寫及電解原理的應用的知識。


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:填空題
(14分)A、B、C、D 4種元素,A元素所處的周期數、主族序數、原子序數均相等;B的原子半徑是其所在主族中最小的,B的最高價氧化物對應水化物的化學式為HBO3;C元素原子的最外層電子數比次外層少2個;C的陰離子與D的陽離子具有相同的電子排布,兩元素可形成化合物D2C.
(1)B元素的名稱___ _____;B在周期表中的位置第 ______周期,第________族;
(2)A、B形成的化合物的電子式____ ____;
(3)C的元素符號________,C的最高價氧化物的化學式____ ____;
(4) D的最高價氧化物對應的水化物的化學式____ ____.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)【化學——物質結構與性質】
銅單質及其化合物在很多領域有重要用途,如金屬銅用來制造電線電纜,無水合硫酸銅可用作殺菌劑等。
(1)Cu2+的核外電子排布式為________________。
(2)科學家通過X射線測膽礬中既含有配位鍵,又含有氫鍵,其結構示意圖可簡單表示如下: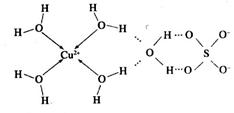
①膽礬的化學式用配合物的形式表示為______。
②膽礬中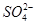 的空間構型為_________,H2O中O原子的雜化方式為____________。
的空間構型為_________,H2O中O原子的雜化方式為____________。
(3)向硫酸銅溶液中加入過量氨水,可生成 配離子。已知
配離子。已知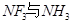 的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,其原因是____________________________。
的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,其原因是____________________________。
(4)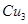 N形成的晶體結構如圖所示,N3-的配位數是________。設晶胞邊長為a cm,密度為b g/cm3,則阿伏加德羅常數可表示為___________(用含a、b的式子表示)。
N形成的晶體結構如圖所示,N3-的配位數是________。設晶胞邊長為a cm,密度為b g/cm3,則阿伏加德羅常數可表示為___________(用含a、b的式子表示)。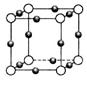
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)【化學——物質結構與性質】
氮族元素包括N、P、As、Sb和Bi五種元素。
(1)下列關于氮族元素的說法正確的是 。
| A.N2可用于填充霓虹燈。其發光原理是電子從能量較低的軌道躍遷到能量較高的軌道,以光的形式釋放能量 |
| B.P、Na、S三種元素的第一電離能由大到小的順序是:P>S>Na |
| C.基態As原子中,電子占據的最高能級為4d |
| D.Bi原子中最外層有5個能量相同的電子 |
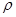 g·cm-3,晶胞的邊長為acm,則阿伏加德羅常數為__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的邊長為acm,則阿伏加德羅常數為__ mol-l(用含ρ、a的式子表示)。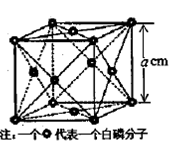
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)A、B、C、D為原子序數依次增大的四種第三周期元素,其單質及其化合物的性質或結構信息如下表所述。
| 元素 | A | B | C | D |
| 性質 結構 信息 | 工業上常用電解熔融AD2制取A的單質。 | B的最外層電子數比最內層電子數多1。 | C的最高價氧化物的水化物經聚合、脫水,可作袋裝食品干燥劑。 | D的一種氣態氧化物甲對空氣的相對密度為3,它溶于水得到單一溶質的弱酸性溶液(有漂白性),該溶液光照后酸性增強。 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)【化學——物質結構與性質】
(1)過渡金屬元素鐵能形成多種配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合鐵(Ⅲ)和Fe(CO)x等。
①基態Fe3+的M層電子排布式為 ;
②尿素(H2NCONH2)分子中C原子的雜化方式是 ;
③配合物Fe(CO)x的中心原子價電子數與配體提供電子數之和為18,則x= 。
Fe(CO)x常溫下呈液態,熔點為-20.5℃,沸點為103℃,易溶于非極性溶劑,據此可判斷Fe(CO)x晶體屬于 (填晶體類型)。
(2)下列說法正確的是 (填字母序號)。
| A.第一電離能大小:S>P>Si |
| B.電負性順序:C<N<O<F |
| C.因為晶格能CaO比KCl高,所以KCl的熔點比CaO熔點低 |
| D.分子晶體中,共價鍵鍵能越大,該分子晶體的熔沸點越高 |
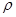 g·cm-3,阿伏加德羅常數為NA,求晶胞邊長a= cm。(用含
g·cm-3,阿伏加德羅常數為NA,求晶胞邊長a= cm。(用含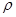 、NA的計算式表示)
、NA的計算式表示)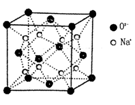
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)甲同學擬通過實驗探究同主族元素性質的遞變規律,以及影響化學反應速率的因素。其設計的實驗方案如下,請你幫他填寫完整,并做出評價。
實驗室提供的試劑:鋅塊、鋅粉、鐵條、鐵粉、銅條、NaBr溶液、NaI溶液、新制的氯水、1mol/L鹽酸、3mol/L的鹽酸
(1)探究同主族元素性質的遞變規律
①寫出下列實驗報告中的實驗現象和離子方程式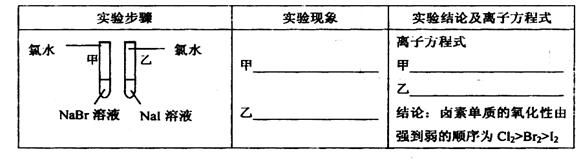
②【評價】甲同學設計的實驗方案的合理性是___________(填序號)
A. 非常合理 B. 部分合理 C. 完全不合理
③【補充和完善】上一題②中若選A,則此項不用再作答,若選B或C,則完成實驗還需要的試劑是___________。
(2)探究影響化學反應速率的因素
| 實驗步驟 | 實驗現象 | 實驗依據和結論 |
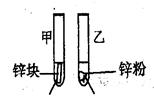 3mL1mol/L 3mL3mol/L 鹽酸 鹽酸 (金屬質量相同,鹽酸均過量) | 均有氣體生成,鋅粉先消失,鋅塊后消失 | 因為乙試管中的反應更快,所以反應物濃度越大,反應速率越快。 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表中列出五種短周期元素A、B、C、D、E的信息,請推斷后回答:
| 元素 | 有 關 信 息 |
| A | 元素主要化合價為-2,原子半徑為0.074 nm |
| B | 所在主族序數與所在周期序數之差為4 |
| C | 原子半徑為0.102 nm,其單質為黃色晶體,可在A的單質中燃燒 |
| D | 最高價氧化物的水化物能按1︰1電離出電子數相等的陰、陽離子 |
| E | 原子半徑為0.075 nm,最高價氧化物的水化物可與其氫化物形成一種鹽X |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
V、W、X、Y、Z是原子序數依次遞減的五種常見元素。X元素是地殼中含量最多的元素,Y、Z組成的氣態化合物M的水溶液呈堿性,W的單質在X2中燃燒產物可使品紅溶液褪色,V是一種歷史悠久、應用廣泛的金屬元素。請回答:
(1)Y元素在周期表中的位置是 ;寫出X、Z兩種元素組成的化合物Z2X2的一種用途: 。
(2)由以上五種元素兩兩組合所形成的化合物中,有一種物質能與水反應生成氣體且反應屬于氧化還原反應,請寫出該反應的化學方程式 。
(3)X、Y、Z三種元素可組成一種強酸U,M在適當條件下被U吸收生成一種鹽。該鹽的水溶液的pH 7(填“大于”、“小于”或“等于”)。原因是(用離子方程式表示)
(4)若將V金屬投入到鹽酸中,生成了淺綠色溶液N。N的酸性溶液與雙氧水反應的離子方程式:
(5)有人設想尋求合適的催化劑和電極材料,以Y2、Z2為電極反應物,以HCl—NH4Cl溶液為電解質溶液制造新型燃料電池,試寫出該電池的正極電極反應式 ;放電時溶液中H+移向 (填“正”或“負”)極。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com