
【題目】隨原子序數的遞增,八種短周期元素(用英文小寫字母表示)原子半徑的相對大小、最高正價或最低負價的變化如下圖所示。
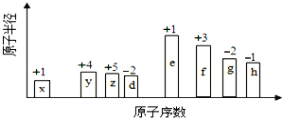
根據判斷出的元素回答問題:
(1)f在元素周期表的位置是_________________。
(2)比較d、e簡單離子的半徑大小(用化學式表示,下同)_____________;比較g、h的最高價氧化物對應的水化物的酸性強弱是______________。
(3)任選上述元素組成一種四原子共價化合物,寫出其電子式________________。
(4)已知1mol e的單質在足量d2中燃燒,恢復至室溫,放出255.5kJ熱量,寫出該反應的熱化學方程式:____________________________________________。
(5)由元素f、h形成的物質X與由元素x、z形成的化合物Y可發生以下反應:
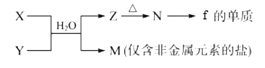
①寫出X溶液與Y溶液反應的離子方程式____________________________________;
②寫出工業上制備f的單質的化學方程式____________________________________。
【答案】第三周期第ⅢA族O2->Na+HClO4>H2SO4![]() (或
(或![]()
![]() ,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)
,答案合理即可)2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根據八種元素的最高正價或最低負價分析,x、y、z、d、e、f、g、h依次處于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,結合原子序數和原子半徑的圖像,x、y、z、d、e、f、g、h依次為H、C、N、O、Na、Al、S、Cl元素。根據元素周期表、元素周期律和相關化學用語作答。
根據八種元素的最高正價或最低負價分析,x、y、z、d、e、f、g、h依次處于第IA族、第IVA族、第VA族、第VIA族、第IA族、第IIIA族、第VIA族、第VIIA族,結合原子序數和原子半徑的圖像,x、y、z、d、e、f、g、h依次為H、C、N、O、Na、Al、S、Cl元素。
(1)f為Al元素,Al在元素周期表的位置是第三周期第IIIA族。
(2)d、e的簡單離子依次為O2-、Na+,O2-、Na+具有相同的電子層結構,核電荷數:O2-<Na+,離子半徑:r(O2-)>r(Na+)。根據“同周期從左到右元素的非金屬性逐漸增強,最高價氧化物對應水化物的酸性逐漸增強”,非金屬性:S<Cl,最高價氧化物對應水化物的酸性:HClO4>H2SO4。
(3)上述元素組成的常見四原子共價化合物有:C2H2、NH3、H2O2等,它們的電子式依次為![]() 、
、![]() 、
、![]() 。
。
(4)Na(s)在O2(g)中燃燒生成Na2O2(s),反應的熱化學方程式為Na(s)+![]() O2(g)=
O2(g)=![]() Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
Na2O2(s)ΔH=-255.5kJ/mol(或2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ/mol)。
(5)由f、h組成的物質X為AlCl3,由x、z形成的化合物Y為NH3;X與Y在水溶液中反應生成M和Z,M是僅含非金屬元素的鹽,M為NH4Cl,Z為Al(OH)3,Al(OH)3受熱分解生成的N為Al2O3,電解熔融Al2O3生成Al和O2。
①X溶液與Y溶液反應的化學方程式為:AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl(或AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl),反應的離子方程式為:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(或Al3++3NH3·H2O=Al(OH)3↓+3NH4+)。
②工業上電解熔融Al2O3制備Al,工業上制備Al的化學方程式為:2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:
【題目】如圖,用2mL95%的乙醇,3mL無水醋酸,2mL濃H2SO4,制某有機溶劑的反應裝置,試管b中加入5mL飽和碳酸鈉溶液。連接好裝置。用酒精燈對試管a加熱,當觀察到試管b中有明顯現象時停止實驗。

(1)在大試管a中配制一定比例的乙醇、乙酸和濃硫酸的混合液的方法是:_______________
(2)寫出a試管中的主要化學反應的方程式:________________
(3)加入濃H2SO4的作用是_____________________。
(4)實驗中球形干燥管除起冷凝作用外,另一個重要作用是___________________________。
(5)試管b中發生的反應_____________________________(離子方程式)
(6)生成乙酸乙酯的反應是可逆反應,反應物不能完全變成生成物,反應一段時間后,就達到了該反應的限度,也即達到化學平衡狀態。下列描述能說明乙醇與乙酸的酯化反應已達到化學平衡狀態的有(填序號)______。
①單位時間里,生成1mol乙酸乙酯,同時生成1mol水
②單位時間里,生成1mol乙酸乙酯,同時生成1mol乙酸
③單位時間里,消耗1mol乙醇,同時消耗1mol乙酸
④正反應的速率與逆反應的速率相等
⑤混合物中各物質的濃度不再變化
(7)現擬分離含乙酸、乙醇和水的乙酸乙酯粗產品,下圖是分離操作步驟流程圖,圖中圓括號表示加入適當的試劑,編號表示適當的分離方法。

①寫出各有機物的名稱:
A __________________,B ____________________ ,E __________________ 。
②寫出加入的試劑:(a)________________,(b)___________________。
③寫出有關的操作分離方法:①______________③_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關分散系的敘述中不正確的是( )
A.膠體分散質微粒直徑較大,不能透過濾紙
B.液態分散系根據分散質粒子大小分為溶液、膠體和濁液三類
C.利用丁達爾效應可以區分溶液和膠體
D.納米材料分散到液體分散劑中得到的分散系屬于膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近期發現,H2S是繼NO、CO之后的第三個生命體系氣體信號分子,它具有參與調節神經信號傳遞、舒張血管減輕高血壓的功能。回答下列問題:
(1)下圖是通過熱化學循環在較低溫度下由水或硫化氫分解制備氫氣的反應系統原理。

通過計算,可知系統(Ⅰ)和系統(Ⅱ)制氫的熱化學方程式分別為________________、____________________________,制得等量H2所需能量較少的是_____________。
(2)H2S與CO2在高溫下發生反應:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中。2 min后,反應達到平衡,水的物質的量為0.01mol。
COS(g) +H2O(g)。在610 K時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中。2 min后,反應達到平衡,水的物質的量為0.01mol。
① H2S的平衡轉化率α=_______%
②從反應開始到平衡,CO2的平均反應速率為_________________
(3)在一定條件下,用H2O2氧化H2S。隨著參加反應的n(H2O2)/n(H2S)變化,氧化產物不同。在酸性溶液中,當n(H2O2)/n(H2S)=4時,寫出離子方程式___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作或現象不能用勒沙特列原理解釋的是
|
|
A.鹵化銀沉淀的轉化 | B.配制FeCl3溶液 |
|
|
C.酯水解程度比較 | D.探究石灰石與稀鹽酸在密閉環境下的反應 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】福韋酯(TDF)主要用于治療艾滋病毒(HIV)感染,化合物W是合成TDF的重要中間體,其合成路線如圖所示。
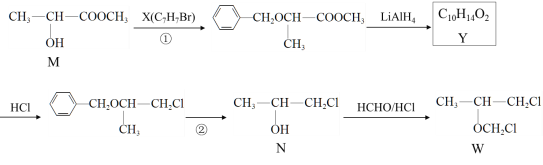
完成下列填空:
(1)N所含官能團的名稱是______________;Y的結構簡式是____________________。
(2)X可用苯的一種同系物制備,所需的無機試劑與條件是____________________。
(3)寫出檢驗W中是否有殘留甲醛的化學方程式____________________________________。
(4)①②的目的是_______________________。
(5)寫出M符合下列條件的一種同分異構體的結構簡式。_______________
i. 與M具有相同官能團 ii. 能發生銀鏡反應
(6)寫出用M為原料制備聚丙烯酸( )的合成路線_______________________ 。
)的合成路線_______________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組欲用下列裝置制備氯水并探究其性質。
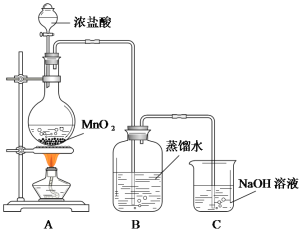
已知:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C裝置的作用是__________________________________。
(2)氯水制備完成后,甲同學從B中取出一定量的樣品置于日光下照射一段時間,發現樣品某些性質發生了明顯的變化,請各列舉一項:
物理性質變化:______________________________________________________;
化學性質變化:_______________________________________________________。
(3)乙同學從B中取出一定量的樣品后通入SO2,充分作用后再滴入少量品紅溶液,發現品紅溶液不褪色。原因是__________________________________(用離子方程式表示)。丙同學改變通入SO2的量,重復乙同學的操作,發現品紅溶液紅色褪去。他提出:假設①:SO2過量,多余的SO2使品紅溶液褪色;假設②:_________________________。請設計實驗驗證假設①是否成立:______________________。
(4)為證明氯氣與水反應產物具有漂白性,丁同學將A中產生的氣體緩緩通過下列裝置:

試劑a應選擇_______________;試劑b應選擇_______________。
(5)戊同學從B中取出少量樣品,滴到NaHCO3粉末上,有無色氣泡產生,由此他認為氯氣與水反應至少產生一種酸性強于碳酸的物質。請評價他的觀點是否正確并說明理由________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、H、O三種元素在人體內質量分數約為73%左右,而在組成巖石圈的化學成分中還不到1%,這一事實說明了( )
A. 生物界與非生物界具有相似性
B. 生物界與非生物界的元素組成是不同的
C. 生物界與非生物界具有統一性
D. 生物界與非生物界存在差異性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com