
【題目】下列由電子排布式所得的結論錯誤的是![]()
選項 | 電子排布式 | 結論 |
A |
| 違背洪特規則 |
B |
| 違背能量最低原理 |
C |
| 違背泡利原理 |
D |
| 違背能量最低原理 |
A.AB.BC.CD.D
 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】一水硫酸四氨合銅晶體[Cu(NH3)4SO4·H2O]常用作殺蟲劑,媒染劑,在堿性鍍銅中也常用作電鍍液的主要成分,在工業上用途廣泛。常溫下該物質可溶于水,難溶于乙醇,在空氣中不穩定,受熱時易發生分解。某化學興趣小組以Cu粉、3mol·L-1的硫酸、濃氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol·L-1稀鹽酸、0.500 mol·L-1 的NaOH溶液來制備一水硫酸四氨合銅晶體并測定其純度。
I.CuSO4溶液的制取
①實驗室用銅與濃硫酸制備硫酸銅溶液時,往往會產生有污染的SO2氣體,隨著硫酸濃度變小,反應會停止,使得硫酸利用率比較低。
②實際生產中往往將銅片在空氣中加熱,使其氧化生成CuO,再溶解在稀硫酸中即可得到硫酸銅溶液;這一過程缺點是銅片表面加熱易被氧化,而包裹在里面的銅得不到氧化。
③所以工業上進行了改進,可以在浸入硫酸中的銅片表面不斷通 O2,并加熱;也可以在硫酸和銅的混合容器中滴加 H2O2 溶液。
④趁熱過濾得藍色溶液。
(1)某同學在上述實驗制備硫酸銅溶液時銅有剩余,該同學將制得的CuSO4溶液倒入另一蒸發皿中加熱濃縮至有晶膜出現,冷卻析出的晶體中含有白色粉末,試解釋其原因________________。
(2)若按③進行制備,請寫出Cu在H2O2 作用下和稀硫酸反應的化學方程式_______________。
(3)H2O2溶液的濃度對銅片的溶解速率有影響。現通過下圖將少量30%的H2O2溶液濃縮至40%,在B處應增加一個設備,該設備的作用是____________餾出物是 ______________________。


II.晶體的制備
將上述制備的CuSO4溶液按如圖所示進行操作
(1)硫酸銅溶液含有一定的硫酸,呈酸性,加入適量NH3·H2O調節溶液pH,產生淺藍色沉淀,已知其成分為 Cu2(OH)2SO4,試寫出生成此沉淀的離子反應方程式__________。
(2)繼續滴加 NH3·H2O,會轉化生成深藍色溶液,請寫出從深藍色溶液中析出深藍色晶體的方法____________。并說明理由____________。
Ⅲ.產品純度的測定
精確稱取 mg 晶體,加適量水溶解,注入圖示的三頸瓶中,然后逐滴加入足量 NaOH 溶液, 通入水蒸氣,將樣品液中的氨全部蒸出,并用蒸餾水沖洗導管內壁,用 V1mL 0.500mol·L-1 的鹽酸標準溶液完全吸收。取下接收瓶,用 0.500 mol·L-1 NaOH 標準溶液滴定過剩的 HCl(選用 甲基橙作指示劑),到終點時消耗 V2mLNaOH 溶液。

1.水 2.長玻璃管 3.10%NaOH溶液 4.樣品液 5.鹽酸標準溶液
(1)玻璃管2的作用________________。
(2)樣品中產品純度的表達式________________。(不用化簡)
(3)下列實驗操作可能使氨含量測定結果偏低的原因是_________________
A.滴定時未用 NaOH 標準溶液潤洗滴定管
B.滴定過程中選用酚酞作指示劑
C.讀數時,滴定前平視,滴定后俯視
D.取下接收瓶前,未用蒸餾水沖洗插入接收瓶中的導管外壁
E.由于操作不規范,滴定前無氣泡,滴定后滴定管中產生氣泡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鹽(如ZnS2O4)在工業中用作漂白劑、解毒劑、吸氧劑等,用途十分廣泛。
Ⅰ.制取ZnS2O4溶液和晶體
控制3545℃進行反應,原理為:Zn+2SO2=ZnS2O4。
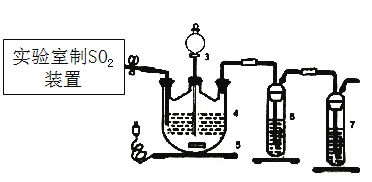
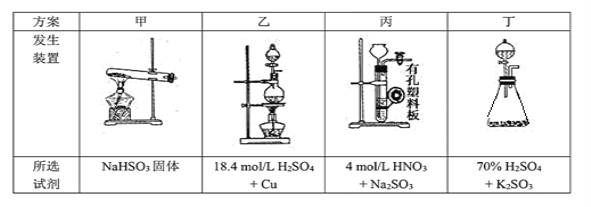
(1)下列四種制備SO2的方案中最佳選擇是___________。
(2)停止電加熱,儀器3放入一定量乙醇,制得ZnS2O4晶體,主要原因是_________。
Ⅱ.測定產率
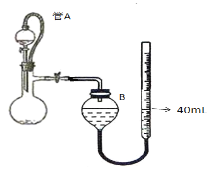
(3)儀器4中加入mg鋅粉與一定量的水,電加熱并啟動磁力攪拌器5。一段時間后,待固體物質完全消失時,關閉活塞和止水夾。取ZnS2O4晶體的十分之一放于真空容器中,加適量的水、通適量氧氣使其恰好轉化為Zn(HSO4)2和Zn(HSO3)2固體,然后加入足量的硫酸,通過測定生成氣體的體積來求算ZnS2O4晶體的產率。請回答下列相關問題:
①測定裝置中,導管A的作用:一是________;二是________。
②為提高測定的準確度,儀器B中最宜選用_____________。
A.飽和食鹽水 B.飽和NaHSO3溶液 C. 飽和澄清石灰水 D.98.3%的濃硫酸
③用圖中量氣管讀數為起點,若終點讀數為17.60mL,且實驗溫度下氣體摩爾體積為VmL.mol-1,可得出ZnS2O4的產率為 ____________%。
(4)如果反應溫度超過45℃,會導致ZnS2O4分解,儀器4中有黃色沉淀、白色沉淀且伴隨著氣泡生成,則ZnS2O4分解的化學方程式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列反應的平衡常數的數值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030;
N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081;
2H2O(g) K2=2×1081;
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92。
2CO(g)+O2(g) K3=4×10-92。
以下說法正確的是( )
A.常溫下,NO分解產生O2的反應的平衡常數表達式為K1=c(N2)·c(O2)
B.常溫下,水分解產生O2,此時平衡常數的數值約為5×10-82
C.常溫下,NO、H2O、CO2三種化合物分解放出O2的傾向由大到小的順序為NO>H2O>CO2
D.以上說法都不正確
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是![]()
A.ns能級上單個電子的能量不一定高于![]() 能級上單個電子的能量
能級上單個電子的能量
B.基態C原子的電子排布式![]() 違反了洪特規則
違反了洪特規則
C.基態Sc原子的電子排布式![]() 違反了能量最低原理
違反了能量最低原理
D.基態Ti原子的電子排布式![]() 違反了泡利原理
違反了泡利原理
查看答案和解析>>
科目:高中化學 來源: 題型:
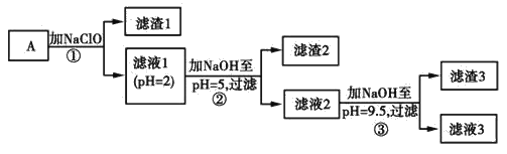
【題目】某礦樣用過量酸溶解并過濾,所得濾液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九種離子中的七種。將A中金屬元素進行分離以備利用,部分流程如圖所示:
可能用到的有關數據如下:
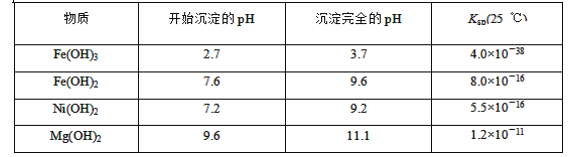
請根據題給信息填空:
(1)濾液A中不能大量存在的兩種離子是________。
(2)已知“濾渣1”是MnO2,步驟①發生的氧化還原反應的離子方程式為________。
(3)常溫下,某Ni(OH)2、Mg(OH)2共沉淀的混合體系中,若c(Ni2+)=5.5×10-11mol·L-1,則c(Mg2+)=________。
(4)假定步驟①中NaClO恰好反應,欲檢驗濾液3中的酸根離子,需優先檢驗________(填離子符號)。
(5)為測定該礦樣中鐵元素的含量,取20.0 g礦石,按上述流程操作,將________(填“濾渣1”、“濾渣2”或“濾渣3”)完全酸溶,再使其中的鐵元素還原為Fe2+,然后將所得溶液稀釋到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。達到滴定終點時溶液顏色為________色,共消耗KMnO4溶液16. 00 mL,經計算礦樣中鐵元素的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,裝置正確且能達到實驗目的的是( )
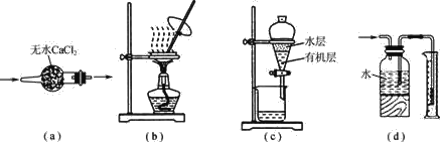
A.用圖a所示裝置干燥SO2氣體
B.用圖b所示裝置蒸發CH3COONa溶液得醋酸鈉晶體
C.用圖c所示裝置分離有機層與水層,水層從分液漏斗下口放出
D.用圖d所示裝置測量氨氣的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性氧化鋅用作橡膠硫化的活性劑、補強劑。以氧化鋅粗品為原料制備活性氧化鋅的生產工藝流程如下:

一些陽離子以氫氧化物形式完全沉淀時溶液的pH見下表:

(1)“溶解”前將氧化鋅粗品粉碎成細顆粒,目的是_____。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,還含有Fe2+、Cu2+等雜質。先加入____(填“Na2CO3”或“H2SO4”)調節溶液的pH至5.4,然后加入適量KMnO4,Fe2+轉化為Fe(OH)3,同時KMnO4轉化為MnO2。經檢測溶液中Fe2+的濃度為0.009mol·L-1,則每升溶液中至少應加入__molKMnO4。
(3)雜質Cu2+可利用置換反應除去,應選擇的物質是_____。
(4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅燒”在450℃~500℃下進行,“煅燒”反應的化學方程式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、R為前四周期元素,原子序數依次增大。X、Y同周期,X基態原子的最外層電子數是次外層的2倍,Y基態原子的s能級和p能級上電子數相等;Z是地殼中含量最高的金屬元素;R+離子的3d軌道全充滿。請回答下列問題:
(1)Z3+離子的核外電子排布式是_______。
(2)科學家成功地在高壓下將XY2轉化為具有類似SiO2結構的原子晶體,該晶體中X原子的雜化軌道類型是_______;X、Z、R的單質分別與足量Y2充分反應所得產物的熔點由高到低的順序是_______。(填化學式)
(3)由Y、R形成的某化合物的晶胞結構如圖所示,其化學式是_______。
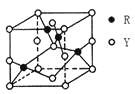
(4)常溫下,pH相同的NaZY2與Na2XY3兩種溶液,物質的量濃度較大的是_______。(填化學式)
(5)將亞硫酸鈉的水溶液逐滴加入RCl2的水溶液中,再加入少量濃鹽酸混勻,得到難溶的白色沉淀RCl,該反應的離子方程式是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com