
【題目】(1)據科技日報網報道,南開大學科研團隊借助鎳和苯基硼酸共催化劑,首次實現烯丙醇高效、綠色合成。烯丙醇的結構簡式為![]() 。請回答下列問題:
。請回答下列問題:
①基態鎳原子的價電子排布式為________。
②![]() 鍵,烯丙醇分子中碳原子的雜化類型是__________。
鍵,烯丙醇分子中碳原子的雜化類型是__________。
(2)乙炔是有機合成的一種重要原料。實驗室可用![]() 與水反應得到乙炔。
與水反應得到乙炔。
①將乙炔通入![]() 溶液中生成
溶液中生成![]() 紅棕色沉淀。基態
紅棕色沉淀。基態![]() 的核外電子排布式為____。
的核外電子排布式為____。
②乙炔與![]() 反應可得丙烯腈(
反應可得丙烯腈(![]() ),丙烯腈分子中碳原子的的雜化軌道類型是_______,分子中含有
),丙烯腈分子中碳原子的的雜化軌道類型是_______,分子中含有![]() 鍵的數目為___________。
鍵的數目為___________。
科目:高中化學 來源: 題型:
【題目】有五種元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。![]() 元素為主族元素,
元素為主族元素,![]() 原子的
原子的![]() 層上有兩個未成對電子且無空軌道;
層上有兩個未成對電子且無空軌道;![]() 原子的價電子排布式為
原子的價電子排布式為![]() ;Z原子的
;Z原子的![]() 電子層的
電子層的![]() 亞層上有一個空軌道;
亞層上有一個空軌道;![]() 原子的
原子的![]() 電子層的
電子層的![]() 亞層上只有一對成對電子;
亞層上只有一對成對電子;![]() 原子的
原子的![]() 電子層上
電子層上![]() 軌道半充滿。下列敘述不正確的是( )
軌道半充滿。下列敘述不正確的是( )
A.元素![]() 和
和![]() 可形成化合物
可形成化合物![]()
B. ![]() 與
與![]() 的最高價氧化物對應的水化物,前者的酸性比后者強
的最高價氧化物對應的水化物,前者的酸性比后者強
C. ![]() 和
和![]() 結合生成的化合物為離子化合物
結合生成的化合物為離子化合物
D.![]() 是由極性鍵構成的非極性分子
是由極性鍵構成的非極性分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[物質結構與性質]
[Zn(CN)4]2–在水溶液中與HCHO發生如下反應:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基態核外電子排布式為____________________。
(2)1 mol HCHO分子中含有σ鍵的數目為____________mol。
(3)HOCH2CN分子中碳原子軌道的雜化類型是______________。
(4)與H2O分子互為等電子體的陰離子為________________。
(5)[Zn(CN)4]2–中Zn2+與CN–的C原子形成配位鍵。不考慮空間構型,[Zn(CN)4]2–的結構可用示意圖表示為_____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅在工業中有重要作用,也是人體必需的微量元素。回答下列問題:
(1)![]() 中含有離子鍵,
中含有離子鍵,![]() 不溶于有機溶劑而
不溶于有機溶劑而![]() 、
、![]() 、
、![]() 能夠溶于乙醇、乙醚等有機溶劑,原因是__________。
能夠溶于乙醇、乙醚等有機溶劑,原因是__________。
(2)《中華本草》等中醫典籍中,記載了爐甘石(![]() )入藥,可用于治療皮膚炎癥或表面創傷。
)入藥,可用于治療皮膚炎癥或表面創傷。![]() 中,陰離子空間構型為__________,
中,陰離子空間構型為__________,![]() 原子的雜化形式為__________。
原子的雜化形式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲線如圖。下列說法不正確的是

A.HA的電離平衡常數Ka=10-5
B.點①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.點③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.點④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源問題是現代社會發展的三大基本問題之一。
(1)焦炭可用于制取水煤氣。實驗測得1.2g碳與水蒸氣完全反應生成水煤氣時,吸收了13.16kJ熱量。該反應的熱化學方程式為___;該反應在條件下能自發進行___(選“高溫”、“低溫”或“任意溫度”)。
(2)甲醇(CH3OH)廣泛用作燃料電池的燃料,工業上可由CO和H2來合成,化學方程式為CO(g)+2H2(g)![]() CH3OH(g)。如圖是在不同溫度下CO的轉化率隨時間變化的曲線。
CH3OH(g)。如圖是在不同溫度下CO的轉化率隨時間變化的曲線。

①T1___T2(填“>”、“<”或“=”)。T1和T2溫度下的平衡常數大小關系是K1___(填“>”、“<”或“=”)K2。
②若容器容積不變,下列措施不能增加CO轉化率的是___(填字母)。
a.降低溫度
b.將CH3OH(g)從體系中分離
c.使用合適的催化劑
d.充入He,使體系總壓強增大
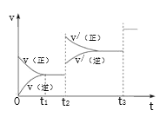
③生成甲醇的化學反應速率(v)與時間(t)的關系如圖所示。則圖中t2時采取的措施可能是___;t3時采取的措施可能是___。
④若在T1℃時,往一密閉容器通入等物質的量CO和H2測得容器內總壓強1MPa,40min達平衡時測得容器內總壓強為0.6MPa,計算生成甲醇的壓強平衡常數KP=___(MPa)-2(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鉻具有極高的硬度和力學強度、優異的抗腐蝕性能和高溫穩定性能,因而具有廣泛應用前景。實驗室制備CrN 反應原理為 CrCl3 +NH3![]() CrN+3HCl,裝置如圖所示
CrN+3HCl,裝置如圖所示
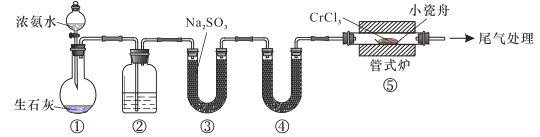
下列說法錯誤的是
A.裝置①還可以用于制取O2、Cl2、CO2等氣體
B.裝置②、④中分別盛裝NaOH溶液、KOH固體
C.裝置③中也可盛裝維生素c,其作用是除去氧氣
D.裝置⑤ 中產生的尾氣冷卻后用水吸收得到純鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.6.0gSiO2晶體中含有共價鍵的數目為 0.2NA
B.標準狀況下,22.4L甲醇中含有的 C-H 鍵數目為 0.3NA
C.室溫下,53.5gNH4Cl晶體溶于氨水中,所得溶液 pH=7,NH![]() 的數目為NA
的數目為NA
D.用鉛蓄電池電解氯化鈉溶液,得到22.4L H2,鉛蓄電池中消耗氫離子數為4NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com