
【題目】用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如表(KMnO4溶液用稀硫酸酸化),實驗裝置如圖1:

實驗序號 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.0lmol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
(1)該反應的化學方程式為__________。
(2)該實驗探究的是__________因素對化學反應速率的影響。相同時間內針筒中所得CO2的體積
大小關系是__________ < __________ (填實驗序號)。
(3)若實驗①在2min末收集了 2.24mLCO2 (標準狀況下),則在2min末,c(MnO4-) =__________ mol·L-1。(假設混合溶液體積為50mL)
(4)除通過測定一定時間內CO2的體積來比較反應速率,本實驗還可通過測定__________來比較化學反應速率。(一條即可)
(5)小組同學發現反應速率隨時間的變化如圖2所示,其中t1t2時間內速率變快的主要原因可能是:
①__________ ; ②__________ 。
【答案】 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 濃度 ① ② 0.0056 KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間 該反應放熱 產物Mn2+是反應的催化劑
【解析】(1)KMnO4和H2C2O4發生氧化還原反應生成錳離子、二氧化碳、水,KMnO4和中錳降低了5價,1個H2C2O4分子中有2個+3價的C,所以升高1×2=2價,根據化合價升降總數相等可以確定KMnO4和H2C2O4的比例關系為:2:5,再根據電荷守恒配平離子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)對比①②實驗可探究草酸的濃度對化學反應速率的影響,②中A溶液的濃度比①中大,化學反應速率大,相同時間所得CO2的體積大;
(3)CO2的物質的量為: ![]() =0.0001mol,設2min末,反應消耗的n(MnO4-)為x,
=0.0001mol,設2min末,反應消耗的n(MnO4-)為x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
210
x0.0001mol
解得 x=0.00002mol
反應剩余的高錳酸根離子的物質的量為:30×10-3L×0.01molL-1-0.00002mol=0.00028mol
c(MnO4-)=![]() =
=![]() =0.0056mol/L;
=0.0056mol/L;
(4)除通過測定一定時間內CO2的體積來比較反應速率,本實驗還可以通過測定KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間來比較化學反應速率;
(5)研究發現反應速率總是如圖2所示發生變化,則t1~t2時間內速率變快的主要原因可能是:①該反應為放熱反應,反應放出的熱量使環境溫度升高,加快了反應速率;②產物Mn2+是反應的催化劑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】我國藥學家屠呦呦因發現植物黃花蒿葉中含有抗瘧疾的物質﹣青蒿素而榮獲2015年諾貝爾獎.科學家對青蒿素的結構進行進一步改良,合成藥效更佳的雙氫青蒿素、蒿甲醚.下列說法不正確的是
A. 利用黃花蒿葉研究青蒿素結構的基本步驟為:分離、提純→元素分析確定實驗式→測定相對分子質量確定分子式→波譜分析確定結構式
B. 雙氫青蒿素在水中的溶解性大于青蒿素
C. ①、②的反應類型分別為還原反應、取代反應
D. 青蒿素轉化為雙氫青蒿素,手性碳個數不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前,一種新的制備聯氨(N2H4)的方法分為兩步。
第一步: NH3和Cl2在液態丙酮![]() 中反應合成異肼
中反應合成異肼![]() ,同時有“白煙”產生;
,同時有“白煙”產生;
第二步:異胼水解生成聯氨和丙酮。
巳知:通常條件下,聯氨是易吸收水和CO2的液體:堿性條件下,能與AgNO3溶液反應生成Ag和N2。
請回答下列問題:
某小組在實驗室應用上述方法制備聯氨水合物并測定該水合物的組成,設計實驗如下(夾持裝置略去)。
I.聯氨水合物的制備。

(1)上述裝置正確的連接順序為a―(________)―bc― ( )― ( ) f(填儀器接口字母),盛放丙酮的儀器名稱為____________。
(2)用連接好的裝置進行實驗;
①檢驗裝置的氣密性,加入藥品;
②排盡裝置中的空氣;
③向丙酮中緩慢通入NH3和Cl2,進行第一步反應,該反應的化學方程式為____________。 設計實驗證明“白煙”的主要成分為NH4Cl:____________;
④完全反應后,再向其中滴加足量蒸餾水,發生第二歩反應。
Ⅱ.測定聯氨水水合物的組成。
(3)實驗步驟:
①取裝置B中完全反應后的液體,蒸餾,收集聯氨水合物。下列蒸餾裝置中合理的是________(填選項字母,夾持裝置略去),若蒸餾操作開始后,發現蒸餾燒瓶中沒有添加沸石,處理方法為_______________。

②取5.0 g聯氨水合物,加人適量NaOH溶液,再加人足量AgNO3溶液;充分反應后,過濾、洗滌、干燥、稱量,得固體質量為43.2g,則聯氨水合物的化學式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎,研究物質的組成、結構、性質及其變化規律的自然科學。學習科學研究的基本方法,可以加深對科學本質的認識,增進對物質世界的認識。下列有關敘述不正確的是

A. 用測定接近水的沸點的水蒸氣相對分子質量的方法可知水分子間可以形成氫鍵
B. 相對分子質量的測定常用質譜儀,在質譜儀內,有機化合物分子在高真空環境下被高能電子束轟擊后主要形成帶負電的碎片
C. 利用紅外光譜、核磁共振氫譜等現代物理方法或化學方法均可測定C2H6O的分子結構
D. 某有機物分子式為C11H14O2,其H—NMR圖譜如右圖(峰右側或上面的數字表示H的個數,且知:7.2ppm(5H)為苯基),可推測該有機物可能為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究催化劑對化學反應有重要意義。為探究催化劑對雙氧水分解的催化效果,某研究小組做了如下實驗:

(1)甲同學欲用圖所示實驗來證明MnO2是H2O2分解反應的催化劑。該實驗__________(填“能”或“不能”)達到目的,原因是__________。(若能,不必回答原因)
(2)為分析Fe3+和Cu2+對H2O2分解反應的催化效果,丙同學設計如下實驗(三支試管中均盛有10mL5%H2O2)
試管 | 夏 | II | III |
滴加試劑 | 5滴0.lmol·L-1FeCl3 | 5 滴 0.1mol·L-1 CuCl2 | 5 滴 0.3mol·L-1 NaCl |
產生氣泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
由此得到的結論是__________,設計實驗Ⅲ的目的是__________。
(3)在上述實驗過程中,分別檢測出溶液中有二價鐵生成,査閱資料得知:將作為催化劑的FeCl3溶液加入H2O2溶液后,溶液中會發生兩個氧化還原反應,且兩個反應中H2O2均參加了反應,試從催化劑的角度分析,這兩個氧化還原反應的化學方程式分別是__________和__________(按反應發生的順序寫)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。對于一定體積密閉容器中的反應:N2(g)+3H2(g)![]() NH3(g)(正反應為放熱反應),673K、30MP下,n (NH3)和n (H2)隨時間t變化的關系如圖所示.下列敘述中,不正確的是()
NH3(g)(正反應為放熱反應),673K、30MP下,n (NH3)和n (H2)隨時間t變化的關系如圖所示.下列敘述中,不正確的是()

A. 點c處正反應速率比逆反應速率大 B. 點a的正反應速率比點b的正反應速率大
C. 氣體的平均摩爾質量:點b大于點a D. 混合氣體的密度:點b大于點a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語表述一定正確的是
A.甲醛的電子式:![]()
B.苯酚鈉溶液中中通入少量二氧化碳氣體:![]()
C.溴乙烷與氫氧化鈉水溶液共熱:![]()
D.乙醇與灼熱的氧化銅反應:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列給出的各組物質,不能完成下列轉化的是( )
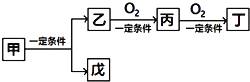
物質 選項 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
B | NH4Cl | NH3 | N2 | NO2 | HCl |
C | NaCl | Na | Na2O | Na2O2 | Cl2 |
D | CH4 | C | CO | CO2 | H2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com