
【題目】單質鈦(Ti)抗腐蝕能力強(放在大海中幾周后仍金光閃閃),機械強度高,有“未來金屬”之稱。又因用它制的“骨頭”置入人體后可以在上面長肉,所以又有“親生物金屬”之美譽。工業上常用硫酸分解鈦鐵礦(FeTiO3,鐵為+2價)的方法來制取TiO2,再由TiO2制金屬鈦。主要反應有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
上述反應中,屬于氧化還原反應的有( )
A.①②
B.①⑤
C.③④
D.④⑤
【答案】D
【解析】
有元素化合價變化的反應是氧化還原反應。
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O反應中,元素化合價都沒變,屬于非氧化還原反應;
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4反應中,元素化合價都沒變,屬于非氧化還原反應;
③H2TiO3![]() TiO2+H2O反應中,元素化合價都沒變,屬于非氧化還原反應;
TiO2+H2O反應中,元素化合價都沒變,屬于非氧化還原反應;
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑反應中,碳元素化合價升高、氯元素化合價降低,有元素化合價變化,屬于氧化還原反應;
TiCl4↑+2CO↑反應中,碳元素化合價升高、氯元素化合價降低,有元素化合價變化,屬于氧化還原反應;
⑤TiCl4+2Mg![]() 2MgCl2+Ti反應中,鎂元素化合價升高、鈦元素化合價降低,有元素化合價變化,屬于氧化還原反應;
2MgCl2+Ti反應中,鎂元素化合價升高、鈦元素化合價降低,有元素化合價變化,屬于氧化還原反應;
綜上所述,④⑤屬于氧化還原反應,故選D。


科目:高中化學 來源: 題型:
【題目】甲醇是一種新型的汽車動力燃料。回答下列問題:
⑴工業上可通過![]() 和
和![]() 化合來制備甲醇。已知某些化學鍵的鍵能數據如下表:
化合來制備甲醇。已知某些化學鍵的鍵能數據如下表:
化學鍵 |
|
|
|
|
|
鍵能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 與
與![]() 之間為三鍵,則工業制備甲醇的熱化學方程式為________。
之間為三鍵,則工業制備甲醇的熱化學方程式為________。
⑵某化學研究性學習小組模擬工業合成甲醇的反應,在容積固定為![]() 的密閉容器內充入
的密閉容器內充入![]() 和
和![]() ,加入合適催化劑(體積可以忽略不計),在
,加入合適催化劑(體積可以忽略不計),在![]() 時開始反應,并用壓力計監測容器內壓強的變化如下表:
時開始反應,并用壓力計監測容器內壓強的變化如下表:
反應時間/ | 0 | 5 | 10 | 15 | 20 | 25 |
壓強/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
則從反應開始到![]() 時,以
時,以![]() 表示的平均反應速率
表示的平均反應速率![]() ________,該溫度下平衡常數
________,該溫度下平衡常數![]() ________
________![]() ,若升高溫度,則
,若升高溫度,則![]() 值________(填“增大”“減小”或“不變")。
值________(填“增大”“減小”或“不變")。
⑶模擬工業合成甲醇的反應,下圖是4種投料比![]() 分別為
分別為![]() 、
、![]() 、
、![]() 、
、![]() 下,反應溫度對
下,反應溫度對![]() 平衡轉化率影響的曲線。
平衡轉化率影響的曲線。

①曲線![]() 對應的投料比為________。
對應的投料比為________。
②當曲線![]() 、
、![]() 、
、![]() 對應的投料比達到相同的
對應的投料比達到相同的![]() 平衡轉化率時,對應的反應溫度與投料比的關系是________。
平衡轉化率時,對應的反應溫度與投料比的關系是________。
③投料比為![]() 、反應溫度為
、反應溫度為![]() 時,平衡混合氣中
時,平衡混合氣中![]() 的物質的量分數是________(精確到
的物質的量分數是________(精確到![]() )。
)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向容積為2 L的密閉容器中充人2 mol A氣體和1 mol B氣體,在一定條件下發生如下反應:2A(g)+B(g)![]() 3C(g);經2 s后達到平衡,測得C氣體的濃度為0.6 mol·L-1。下列說法中正確的是
3C(g);經2 s后達到平衡,測得C氣體的濃度為0.6 mol·L-1。下列說法中正確的是
①用物質A表示該反應的平均反應速率為0.2 mol·L-1·s-1
②用物質B表示該反應的平均反應速率為0.2 mol·L-1·s-1
③平衡時物質A與B的轉化率相等
④平衡時物質B的濃度為0.2 mol·L-1
⑤其他條件不變,向容器中再加入1 molC氣體,達到新平衡時,C的體積分數不變
A. ①②③B. ①③⑤C. ②④⑤D. ①④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將70g過氧化鈉和氧化鈉混合物與98g水充分反應,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中過氧化鈉和氧化鈉的質量分別是多少?___
(2)所得氫氧化鈉溶液的質量分數是多少?___
查看答案和解析>>
科目:高中化學 來源: 題型:
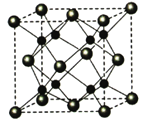
【題目】[化學—選修3:物質結構與性質](15分)A、B、C、D為原子序數依次增大的四種元索,A2-和B+具有相同的電子構型;C、 D為同周期元索,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子。回答下列問題:
(1)四種元素中電負性最大的是 (填元素符號),其中C原子的核外電子排布式為__________。
(2)單質A有兩種同素異形體,其中沸點高的是 (填分子式),原因是 ;A和B的氫化物所屬的晶體類型分別為 和 。
(3)C和D反應可生成組成比為1:3的化合物E, E的立體構型為 ,中心原子的雜化軌道類型為 。
(4)化合物D2A的立體構型為 ,中心原子的價層電子對數為 ,單質D與濕潤的Na2CO3反應可制備D2A,其化學方程式為 。
(5)A和B能夠形成化合物F,其晶胞結構如圖所示,晶胞參數,a=0.566nm, F 的化學式為 :晶胞中A 原子的配位數為 ;列式計算晶體F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】功能高分子P的合成路線如下:

(1)A的分子式是C7H8,其結構簡式是___________________。
(2)試劑a是_______________。
(3)反應③的化學方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能團:_______________。
(5)反應④的反應類型是_______________。
(6)反應⑤的化學方程式:_______________。
(5)已知:2CH3CHO 。
。
以乙烯為起始原料,選用必要的無機試劑合成E,寫出合成路線(用結構簡式表示有機物),用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醫學上經常用硫酸亞鐵糖衣片給這種貧血病人補鐵。現取20粒糖衣片,質量為10g,溶于40g水中,向所配溶液中滴加氫氧化鈉溶液至略過量過濾、洗滌、干燥,然后進行灼燒到固體質量不再發生改變,質量為0.8g。試計算:
(1)該糖衣片中硫酸亞鐵的質量分數______。
(2)1粒糖衣片中含鐵元素的質量______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞鐵鹽、鐵鹽在工農業生產、生活、污水處理等方面有著極其廣泛的應用,現用鐵屑與硫酸反應制備硫酸亞鐵。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亞鐵在水中的溶解度如下圖:
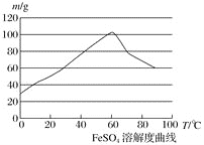
(1)首先,將鐵屑放入碳酸鈉溶液中煮沸除油污,分離出液體,用水洗凈鐵屑。此步驟中,分離出液體的方法通常不用過濾,使用的操作是____________(填寫操作名稱)。
(2)向處理過的鐵屑中加入適量的硫酸,在一定溫度下使其反應到不再產生氣體,趁熱過濾,得硫酸亞鐵溶液。
①硫酸濃度應選擇(填字母序號)__________;
A.濃硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意濃度硫酸
②溫度宜控制在________,加熱的同時需適當補充水,原因是___________________;
③反應中應保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亞鐵鹽在空氣中易被氧化,但形成復鹽可穩定存在,如“摩爾鹽”,即(NH4)2SO4·FeSO4·6H2O(硫酸亞鐵銨),就是在硫酸亞鐵溶液中加入少量稀硫酸溶液,再加入飽和硫酸銨溶液,經過_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某火電廠收捕到的粉煤灰的主要成分為SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小組對其進行綜合處理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后鈦主要以TiOSO4形式存在,強電解質TiOSO4在溶液中僅能電離SO42-和一種陽離子,該離子會水解,下列說法不正確的是
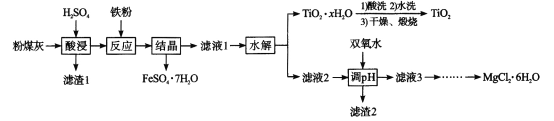
A.“酸浸”時TiO2發生反應的離子方程式為TiO2 +2H+= =TiO2+ +H2O
B.“結晶”時溫度需控制在70℃以上,溫度過低TiO2![]() xH2O產率降低
xH2O產率降低
C.為使濾渣2沉淀完全,需“調pH"最小為4.3
D.MgCl2溶液制備MgCl2![]() 6H2O需要在HCl的氣氛下蒸發濃縮
6H2O需要在HCl的氣氛下蒸發濃縮
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com