
【題目】某有機化合物A的相對分子質量范圍為100~130.經分析得知,其中碳和氫的質量分數之和為46.66%,其余為氧,則該化合物分子中最多含碳氧雙鍵的個數為( )
A.1
B.2
C.3
D.4
 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用.如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:①電解池中X極上的電極反應式為;在X極附近觀察到的現象是 .
②Y電極上的電極反應式為;檢驗該電極反應產物的方法是 .
(2)如用電解方法精煉粗銅,電解液a選用CuSO4溶液,則①X電極的材料是 , 電極反應式為 .
②Y電極的材料是 , 電極反應式為 . (說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可以由下列反應合成三聚氰胺:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN與水反應生成尿素[CO(NH2)2],尿素合成三聚氰胺.
CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN與水反應生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)寫出與Ca在同一周期且最外層電子數為1、內層電子全排滿的基態原子的核外電子排布式: .
(2)CaCN2中陰離子為CN ![]() ,與CN
,與CN ![]() 互為等電子體的分子有N2O和(填化學式),由此可以推知CN
互為等電子體的分子有N2O和(填化學式),由此可以推知CN ![]() 的空間構型為 .
的空間構型為 .
(3)尿素分子中C原子采取雜化.尿素分子的結構簡式是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用氟硼酸(HBF4,屬于強酸)代替硫酸作鉛蓄電池的電解質溶液,可使鉛蓄電池在低溫下工作時的性能更優良,反應方程式為:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2為可溶于水的強電解質,下列說法正確的是
2Pb(BF4)2+2H2O,Pb(BF4)2為可溶于水的強電解質,下列說法正確的是
A. 放電時,負極反應為:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充電時,當正極質量減少23.9g時轉移0.2mol電子
C. 放電時,PbO2電極附近溶液的pH增大
D. 充電時,Pb電極的電極反應式為PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示為CH4燃料電池的裝置(A、B為多孔碳棒):
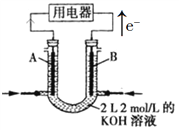
(1)_____(填A或B)處電極入口通甲烷,其電極反應式為_____________。
(2)當消耗甲烷的體積為11.2 L(標準狀況下)時,消耗KOH的質量為_______g。
(3)鉛蓄電池是最早使用的充電電池,由Pb、PbO2、硫酸構成。該電池工作時,正極的電極反應式為____________________。
(4)500 mL KNO3和Cu(NO3)2的混合溶液中c(![]() )=6.0 mol·L1,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL。原混合溶液中c(K+)為_________mol·L1。
)=6.0 mol·L1,用石墨作電極電解此溶液,當通電一段時間后,兩極均收集到22.4 L氣體(標準狀況),假定電解后溶液體積仍為500 mL。原混合溶液中c(K+)為_________mol·L1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物A是農藥生產中的一種中間體,其結構簡式如圖所示. 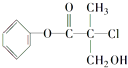
由A的結構推測,它能(填字母).
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.和稀硫酸混合加熱,可以發生取代反應
d.與Na2CO3溶液作用生成CO2
e.1mol A和足量的NaOH溶液反應,最多可以消耗3mol NaOH
f.和NaOH醇溶液混合加熱,可以發生消去反應
g.1mol A和足量的H2反應,最多可以消耗4mol H2 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵分析中常用高氯酸(HClO4)溶解礦樣,某研究性學習小組欲制取少量高氯酸。該學習小組查閱到:
a.HClO4濃度高于60%時遇含碳化合物易爆炸,濃度低于60%時比較穩定;
b.NaClO4與濃硫酸反應可制得高氯酸,若采用真空蒸餾可得純高氯酸;
c.NaClO3在673K(400℃) 分解產生NaClO4、NaCl和一種氣體。
該小組同學設計實驗分三步制備高氯酸:
(一)制氯氣并使制得的氯氣與氫氧化納溶液反應制氯酸納;
(二)氯酸鈉分解制高氯酸鈉;
(三)高氯酸納與濃硫酸反應制高氯酸[2NaClO4+H2SO4(濃)![]() Na2SO4+2HClO4]。
Na2SO4+2HClO4]。
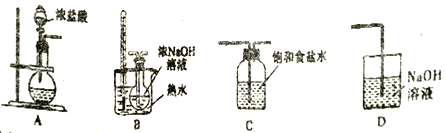
(1)制取氯酸鈉的裝置連接順序為A,___________
(2)B 裝置中發生反應的離子方程式為__________________________。
(3)為了制備高氯酸鈉并推出氯酸鈉分解制高氯酸鈉的化學方程式,該小組設計了兩組裝置(甲,乙)如下:
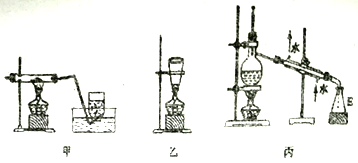
該小組經過分析決定選用甲裝置制備高氯酸鈉,取NaClO3樣品2.13 g,加熱充分反應后集氣瓶中收集到224 mL (標準狀況下)氣體,則該反應的化學方程式為_________________________;不選用乙裝置的原因可能為______________________。
(4)用丙裝置制備高氯酸,向燒瓶中加入高氯酸鈉,然后加入濃硫酸后,加熱可制取高氯酸。實驗開始前,膠塞及導管接口需要包錫箔紙,其原因是___________,儀器E的名稱為___________。該組同學發現操作中少加入一種物質,該物質的名稱為___________。發現后的正確操作為_________________。
(5)工業上大量制備NaClO4常用高電流密度電解NaClO3的方法,試寫出以惰性電極電解時的陽極反應式:_______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于反應:xR2++Cl2=yR3++zCl-的說法中正確的是
A. x=y,R2+得到電子 B. x=2, Cl2作氧化劑
C. y=z,R3+是還原產物 D. x=z, Cl-是氧化產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含A元素的一種單質是一種重要的半導體材料,含 A元素的一種化合物C可用于制造高性能的現代通訊材料——光導纖維,C與燒堿反應生成含A元素的化合物D。
(1)A的原子結構示意圖為________,A與碳在原子的電子層結構上的相同點是________________________________________________________。
(2)易與C發生化學反應的酸是_________(寫名稱),反應的化學方程式是_______________________________。
(3)將C與純堿混合高溫熔融時也發生化學反應生成D
①寫出該反應的化學方程式:___________________________________________。
②要將純堿高溫熔化,下列坩堝中可選用的是________。
A.普通玻璃坩堝 B.石英玻璃坩堝 C.鐵坩堝
(4)100 g C與石灰石的混合物充分反應后,生成的氣體在標準狀況下的體積為11.2 L,100 g混合物中石灰石的質量分數是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com