
【題目】下列敘述中,錯誤的是( )
A.苯與濃硝酸、濃硫酸共熱并保持55-60℃反應生成硝基苯
B.乙苯能發生氧化反應,但不能發生還原反應
C.乙烯與溴的四氯化碳溶液反應生成1,2-二溴乙烷
D.苯乙烯在合適條件下催化加氫可生成乙基環己烷
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:
【題目】在密閉容器里,發生反應2A(g)+B(g)![]() 2C(g)。下列條件不能說明該反應達到平衡的是
2C(g)。下列條件不能說明該反應達到平衡的是
A.2υ正(B)=υ逆(C)
B.該體系的密度不隨時間而變化
C.該體系的溫度不隨時間而變化
D.1molA的化學鍵斷裂,同時1molC的化學鍵也斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常溫下,取體積比2∶3的甲烷和氫氣的混合氣體11.2 L(標準狀況下),經完全燃燒后恢復至室溫,則放出的熱量為( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是( )
A.三氯化鐵溶液與氫氧化鈉溶液反應:FeCl3+3OH-=Fe(OH)3↓+3Cl-
B.氫氧化鋇溶液與硫酸銅溶液反應:Ba2++ SO![]() = BaSO4↓
= BaSO4↓
C.濃硫酸與銅反應:Cu+2H+= Cu2++H2↑
D.石灰石與稀醋酸反應:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉬(Mo)是一種難熔稀有金屬,我國的鉬儲量居世界第二。鉬及其合金在冶金,農業、電器、化工、環保等方面有著廣泛的應用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
則ΔH3=__________(用含ΔH1、ΔH2的代數式表示)。
(2)密閉容器中用Na2CO3(S)作固硫劑,同時用一定量氫氣還原輝鉬礦(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,實驗測得平衡時的有關變化曲線如圖所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,實驗測得平衡時的有關變化曲線如圖所示:
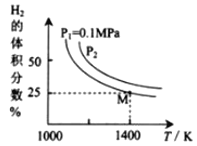
①由圖可知,該反應的ΔH______0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反應在體積不變的密閉容器中達平衡,下列說法錯誤的是______(選填編號)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,則H2轉化率增大
C.容器內氣體的密度不變時,一定達平衡狀態
D.容器內壓強不變時,一定達平衡狀態
③由圖可知M點時氫氣的平衡轉化率為________(計算結果保留0.1%)。
④平衡常數可用平衡分壓代替平衡濃度計算,氣體分壓=氣體總壓×物質的量分數。求圖中M點的平衡常數Kp=______(MPa)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素 X、Y、Z、W的原子序數依次增大,四種元素形成的單質依次為m、n、p、q;r、t、u 是這些元素組成的二元化合物,其中u為葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物質的轉化關系如圖所示,下列說法不正確的是
= 1.0×10-10。上述物質的轉化關系如圖所示,下列說法不正確的是

A. 簡單離子半徑:W>Y>Z>X
B. W,Y分別與X元素形成的簡單化合物的沸點: Y> W
C. Z2Y和ZX都只存在離子鍵
D. v能抑制水的電離,u能促進水的電離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以含鈷廢催化劑(主要成分為Co、Fe、SiO2)為原料制取氧化鈷(Co2O3)的流程如下:

(1)溶解Ⅰ:溶解后過濾,將濾渣洗滌2~3次,洗液與濾液合并,其目的是___________ 。所得濾渣的主要成分是___________ (寫化學式)。
(2) 氧化:加熱攪拌條件下加入NaClO3,將Fe2+氧化成Fe3+,其離子方程式____________ 。
(3) 某研究小組為測定黃鈉鐵礬[NaxFey(SO4)m(OH)n]的組成,進行了如下實驗:
①稱取4.850 g樣品,加鹽酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反應為2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液進行滴定(反應為I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至終點。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反應后,過濾、洗滌、干燥后,得沉淀1.165 g。通過計算確定黃鈉鐵礬的化學式(寫出計算過程) ____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏伽德羅常數的值.下列有關敘述正確的是
為阿伏伽德羅常數的值.下列有關敘述正確的是![]()
A.硝酸與銅反應得到![]() 、
、![]() 共23g,則銅失去的電子數為
共23g,則銅失去的電子數為![]()
B.10g![]() 的乙醇水溶液中所含氫原子數目為
的乙醇水溶液中所含氫原子數目為![]()
C.標準狀況下![]() 的平均相對分子質量為
的平均相對分子質量為![]() 的
的![]() 與
與![]() 含有中子數
含有中子數![]()
D.1molCu與足量的S完全反應,轉移電子數為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com