(1)(19分)①研究性學習小組為了證明鐵的金屬性比銅強,他設計了如下幾種方案,其中合理的是
(填序號)
| A.鐵片置于硫酸銅溶液中有銅析出; |
| B.鐵、銅與氯氣反應分別生成FeCl3、CuCl2; |
| C.銅片置于FeCl3溶液中,銅片逐漸溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.鐵片、銅片分別置于盛有稀硫酸的燒杯中,鐵片上有氣泡產生,而銅片無氣泡 |
E.常溫下,分別將鐵片和銅片置于濃硝酸中,鐵片不溶解,而銅片溶解
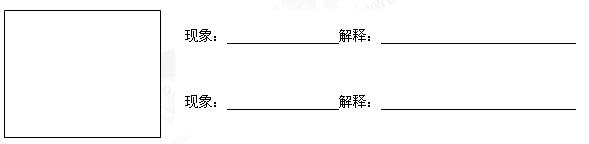
②請你另設計一個能證明鐵的金屬活動性比銅強的實驗。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框內繪出實驗裝置圖并注明所需的藥品;
c.寫出實驗過程中的主要實驗現象并用相關化學用語解釋現象
(2)學完原電池的相關知識后,甲組同學認為構成原電池必須有三個條件:①活動性不同的兩極;②電解質溶液;③閉合回路。乙組同學對條件①提出異議,認為相同的兩極也可以構成原電池,以下為乙組同學的實驗裝置簡圖以及實驗報告的部分內容。請仔細閱讀實驗報告,然后將實驗報告補充完整并填在相應的橫線上。裝置中鹽橋的作用之一是使整個裝置構成閉合回路。
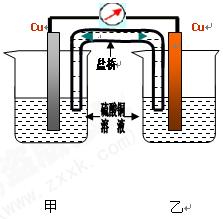
濃差電池與溫差電池
一、【實驗目的】
1、電池中兩杯溶液及電極均相同,兩杯溶液的濃度不同,可否形成原電池
2、電池中兩杯溶液

及電極均相同,兩杯溶液的溫度不同,可否形成原電池
3、電池中兩杯溶液及電極均相同,研究兩杯溶液的
對電池電壓和電流的影響
4、電池中兩杯溶液及電極均相同,研究兩杯溶液的
對電池電壓和電流的影響
二、【儀器與藥品】略。
三、【實驗方法與步驟】
Ⅰ、實驗方法:略。
Ⅱ、研究的步驟
㈠實驗A:濃差電池
電解液均為硫酸銅,電極均為銅片:
1、甲燒杯中固定裝入濃度 0.8 mol/L 的硫酸銅溶液。
2、乙燒杯中分別裝入濃度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸銅溶液。
3、使用銅片當電極。測量這六種組合電池的穩(wěn)定電壓及電流,將結果記錄于表 1。
㈡實驗B:溫差電池
電解液均為硫酸銅,電極均為銅片:(步驟略,結果記錄于表2)
四、【實驗結果】
實驗A:濃差電池:表1
甲杯硫酸銅濃度 mol/L
| 0.8
| 0.8
| 0.8
| 0.8
| 0.8
| 0.8
|
乙杯硫酸銅濃度 mol/L
| 0.8
| 0.4
| 0.2
| 0.1
| 0.05
| 0.025
|
兩杯溶液濃度差值
| 0
| 0.4
| 0.6
| 0.7
| 0.75
| 0.775
|
電壓 mV
| 0
| 6
| 12
| 16
| 22
| 26
|
電流 mA mA
| 0
| 0.02
| 0.04
| 0.06
| 0.07
| 0.08
|
實驗B:溫差電池:表2
甲杯硫酸銅溫度℃
| 19
| 19
| 19
| 19
| 19
| 19
|
乙杯硫酸銅溫度℃
| 19
| 29
| 39
| 49
| 59
| 69
|
兩杯溶液溫差℃
| 0
| 10
| 20
| 30
| 40
| 50
|
電壓 mV
| 0
| 6.1
| 12
| 20
| 27
| 34
|
電流 mA
| 0
| 0.025
| 0.047
| 0.07
| 0.15
| 0.18
|
五、【討論】
1、濃差電池:若硫酸銅濃差電池放電較長一段時間后,可觀察到甲杯高濃度的溶液顏色逐漸變淺,而乙杯顏色變深,而電壓也逐漸下降,同時可觀察到甲杯中銅片表

面有銅析出。
這說明:甲杯中的電極反應式為
乙杯中的電極反應式為

電池放電一段較長時間后電壓下降的原因:
2、溫差電池(略)
六、【結論】
由上述【實驗結果】可得結論:
實驗A:
[來源:學&科&網Z&X&X&K]實驗B:(略)
甲、乙兩小組同學給你什么啟示:
