
【題目】下列說法中正確的是( )
A.硝酸鉀溶液能導電,所以硝酸鉀溶液是電解質
B.石墨有較好的導電性,所以石墨屬于電解質
C.液態氯化氫、固態氯化鈉均不能導電,所以氯化氫、氯化鈉均不是電解質
D.蔗糖在水溶液中和熔融狀態下均不能導電,所以蔗糖是非電解質
 全優沖刺100分系列答案
全優沖刺100分系列答案 英才點津系列答案
英才點津系列答案 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案科目:高中化學 來源: 題型:
【題目】已知A(g)+B(g)C(g)+D(s)反應的平衡常數與溫度的關系如下:
溫度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常數 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列問題:
(1)該反應的平衡常數表達式K= , △H0(填“>、<、或=”);
(2)800℃時,向一個5L的密閉容器中充入0.4molA和0.7molB,若反應初始2mim內A的平均反應速率為0.01molL﹣1min﹣1 , 則2min時c(A)=molL﹣1 , C的物質的量為mol;若經過一段時間后,反應達到平衡時再向容器中充入0.4molA,則再次達到平衡后A的百分含量與第一次平衡相比(填“增大”、“減小”、或“不變”)
(3)下列選項中能作為判斷反應達到平衡的依據有 a.壓強不隨時間改變
b.v(A):v(b)=1:1
c.單位時間內消耗A和B的物質的量相等
d.C的百分含量保持不變
(4)880℃ 時,反應 C(g)+D(s)A(g)+B(g)的平衡常數的值為 .
(5)某溫度時,平衡濃度符合下式:c(A).c(B)=c(C),則該此時的溫度為℃.
(6)圖是1000℃時容器中A的物質的量的變化曲線,請在圖中補畫出該反應在1200℃時A的物質的量的變化曲線圖 . 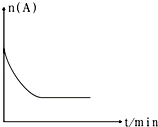
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫恒容的容器中進行反應N2(g)+3H2(g) ![]() 2NH3(g),若氮氣濃度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反應時間為( )
2NH3(g),若氮氣濃度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反應時間為( )
A.等于1.8 s
B.等于1.2 s
C.大于1.8 s
D.小于1.8 s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氯元素及其化合物的表示正確的是( )
A.質子數為17、中子數為20的氯原子 ![]() Cl
Cl
B.氯離子(Cl﹣)的結構示意圖: 
C.氯分子的電子式: ![]()
D.氯乙烯分子的結構簡式:H3C﹣CH2Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在研究金礦床物質組分的過程中,通過分析發現了Cu﹣Ni﹣Zn﹣Sn﹣Fe多金屬互化物.
(1)某金屬互化物屬于晶體,區別晶體和非晶體可通過方法鑒別.該金屬互化物原子在三維空間里呈周期性有序排列,即晶體具有性.
(2)基態Ni2+的核外電子排布式;配合物Ni(CO)4常溫下為液態,易溶于CCl4、苯等有機溶劑.固態Ni(CO)4 屬于晶體.
(3)銅能與類鹵素(SCN)2反應生成Cu(SCN)2 . 1mol(SCN)2分子中含有σ鍵的數目為;類鹵素(SCN)2對應的酸有兩種,理論上硫氰酸(H﹣S﹣C≡N)的沸點低于異硫氰酸(H﹣N=C=S)的沸點,其原因是;
(4)立方NiO(氧化鎳)晶體的結構如圖﹣1所示,其晶胞邊長為apm,列式表示NiO晶體的密度為g/cm3(不必計算出結果,阿伏加德羅常數的值為NA)人工制備的NiO晶體中常存在缺陷(如圖﹣2)一個Ni2+空缺,另有兩個Ni2+被兩個Ni3+所取代,其結果晶體仍呈電中性,但化合物中Ni和O的比值卻發生了變化.已知某氧化鎳樣品組成Ni0.96O,該晶體中Ni3+與Ni2+的離子個數之比為 . 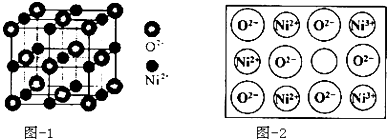
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、![]()
B. 通入過量SO2氣體后的溶液:H+、Ca2+、Fe3+、![]()
C. 通入足量CO2的溶液:H+、![]() 、Al3+、
、Al3+、![]()
D. 與鋁反應產生大量氫氣的溶液:Na+、K+、![]() 、
、![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】900℃時,向2.0L恒容密閉容器中充入0.40mol乙苯,發生反應: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 經一段時間后達到平衡.反應過程中測定的部分數據見下表:
+H2(g)△H=akJ.mol﹣1 . 經一段時間后達到平衡.反應過程中測定的部分數據見下表:
時間/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列說法正確的是( )
A.反應在前20 min的平均速率為v(H2)=0.004molL﹣1min﹣1
B.保持其他條件不變,升高溫度,平衡時,c(乙苯)=0.08molL﹣1 , 則a<0
C.保持其他條件不變,向容器中充入不參與反應的水蒸氣作為稀釋劑,則乙苯的轉化率為50.0%
D.相同溫度下,起始時向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 達到平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com