
【題目】現有反應aA(g)+bB(g) ![]() pC(g),已知:達到平衡后,升高溫度,B的轉化率變大;減小壓強,C的質量分數減小。
pC(g),已知:達到平衡后,升高溫度,B的轉化率變大;減小壓強,C的質量分數減小。
(1)該反應的逆反應是________反應(填“放熱”或“吸熱”),且a+b______p(填“<”、“>”或“=”)。
(2)溫度、容器體積不變,平衡后加入B,A的轉化率_________,B的轉化率_________。(填“增大”、“減小”或“不變”)
(3)若升高溫度,再次平衡時,B、C的濃度之比將_____________。(填“增大”、“減小”或“不變”)
(4)若加入催化劑,再次平衡時氣體混合物的總物質的量___________。(填“增大”、“減小”或“不變”)
(5)若B是有色氣體,A、C無色,平衡后壓縮容器體積為原來的一半,再次平衡時,容器內氣體顏色____。若維持容器內氣體壓強不變,充入Ne,再次平衡時,容器內氣體顏色__________。(填“變深”、“變淺”或“不變”)
【答案】放熱 > 增大 減小 減小 不變 變深 26.放熱@>@增大@減小@減小@不變@變深@變淺
【解析】
本題考查勒夏特列原理,(1)升高溫度,B的轉化率變大,說明反應向正反應方向進行,即正反應方向為吸熱反應,則逆反應為放熱反應;減小壓強,C的質量分數減小,說明反應向逆反應方向進行,即a+b>p;(2)平衡后加入B,增加反應物的濃度,平衡向正反應方向移動,即A的轉化率增大,B的總量增加,即B的的轉化率降低;(3)正反應是吸熱反應,升高溫度,平衡向正反應方向移動,B的物質的量減小,C的物質的量增大,即B、C的濃度之比減小;(4)使用催化劑,對化學平衡無影響,即氣體混合物的總物質的量不變;(5)平衡后壓縮容器的體積,組分的濃度都增大,即氣體顏色加深,恒壓時,充入非反應氣體,容器的體積增大,組分的濃度降低,氣體顏色變淺。


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】I、下圖是全釩液流電池的示意圖
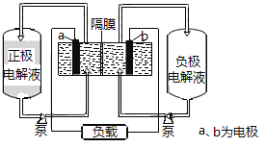
該電池充放電的總反應式為:![]()
請回答下列問題:
(1)充電時的陰極反應式為______________,陽極附近顏色變化是______。
(2)放電過程中,正極附近溶液的pH ________(選填“升高”“降低”或“不變”)。
II、回收利用廢釩催化劑(主要成分為V2O5、VOSO4和二氧化硅)的工藝流程如下圖所示。
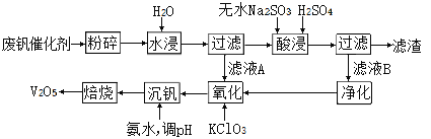
(3)濾渣可用于______________________(填一種用途)。
(4)25℃時,取樣進行實驗分析,得到釩沉淀率和溶液pH之間的關系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
釩沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根據上表數據判斷,加入氨水調節酸堿性,溶液的最佳pH為____;
(5)為了提高釩的浸出率,用酸浸使廢釩催化劑中的V2O5轉變成可溶于水的VOSO4,酸浸過程中,氧化產物和還原產物的物質的量之比為________。
(6)氧化過程中,VO2+變為VO2+,則該反應的離子方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,在一容積不變的密閉容器中發生可逆反應A(g)+3B(g)![]() 2C(g),其達到平衡狀態的標志是( )
2C(g),其達到平衡狀態的標志是( )
A. C生成的速率與C分解的速率相等
B. 單位時間生成n mol A,同時生成3n mol B
C. 體系的密度不再變化
D. A、B、C的濃度之比為1∶3∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是學習化學的重要工具,它隱含許多信息和規律。下表所列是六種短周期元素的原子半徑及主要化合價(已知鈹元素的原子半徑為0.089 nm)。
元素代號 | A | B | C | D | X | Y |
原子半徑/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合價 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置為________,其離子結構示意圖為:_______。
(2)B的最高價氧化物對應的水化物與Y的最高價氧化物對應的水化物反應的離子方程式為___。
(3)關于C、D 兩種元素說法正確的是__________(填序號)。
a.簡單離子的半徑D>C b.氣態氫化物的穩定性D比C強 c.最高價氧化物對應的水化物的酸性C比D強
(4)在100mL18mol/L的C的最高價氧化物對應的水化物的濃溶液中加入過量的銅片,加熱使其充分反應,產生氣體的體積為6.72L(標況下),則該反應過程中轉移的電子數為______。
(5)寫出由A、D、X三種元素組成的某種可以消毒殺菌物質的電子式_____________。
(6)比較Y元素與其同族短周期元素的氫化物的熔沸點高低__ >___ (填氫化物化學式),理由___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下的容積不變的容器中,當下列物理量不再變化時,表明反應A(g)+2B(g)![]() 3C(g)+D(s)已達到平衡的是( )
3C(g)+D(s)已達到平衡的是( )
① 混合氣體的壓強 ② 混合氣體的密度
③ 混合氣體的總質量 ④ 氣體的總物質的量
A. ① ④B. ② ③C. ① ② ③D. ① ②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇可作為燃料電池的原料。通過下列反應可以制備甲醇:CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H =-90.8 kJ·mol-1 ,在一容積可變的密閉容器中充入10 mol CO 和20 mol H2,CO 的平衡轉化率隨溫度(T)、壓強(P)的變化如圖所示,當達到平衡狀態A 時,容器的體積為20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 ,在一容積可變的密閉容器中充入10 mol CO 和20 mol H2,CO 的平衡轉化率隨溫度(T)、壓強(P)的變化如圖所示,當達到平衡狀態A 時,容器的體積為20 L。

(1)T1℃反應的平衡常數為_______________。
(2)圖中P1 _______ P2(填“>”、“<”或“=”)。如反應開始時仍充入10 mol CO和20 mol H2,則在平衡狀態B時容器的體積V(B)=__________L。
(3)關于反應CO(g)+2H2(g)![]() CH3OH(g)在化學平衡狀態B時的描述正確的是________
CH3OH(g)在化學平衡狀態B時的描述正確的是________
A.CO的含量保持不變 B.容器中CH3OH濃度與CO濃度相等
C.2v正(CH3OH)= v正(H2) D.容器中混合氣體的平均相對分子質量保持不變
(4)已知CO2(g)+H2(g) ![]() CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,試寫出由CO2和H2制取甲醇的熱化學方程式___________________________________。
CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,試寫出由CO2和H2制取甲醇的熱化學方程式___________________________________。
(5)以CH3OH、O2、稀H2SO4組成燃料電池,寫出該電池正極的電極反應式:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列條件下,兩種氣體的分子數一定相等的是
A. 同密度、同壓強的 N2 和 C2H4 B. 同溫度、同體積的 O2 和 N2
C. 同體積、同密度的 C2H4 和 CO D. 同壓強、同體積的 O2 和 N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取一小塊鈉放在坩堝里加熱,下列實驗現象正確的是( )
①金屬先熔化 ②在空氣中燃燒,火焰呈黃色 ③燃燒時火星四射
④燃燒后生成淡黃色固體 ⑤燃燒后生成白色固體
A. ①②③ B. ①②④ C. ①②⑤ D. ①③⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com