(14分)二氧化氯(ClO
2)作為一種高效強氧化劑已被聯合國世界衛生組織(WHO)列為AI級安全消毒劑。常溫下二氧化氯為黃綠色或橘黃色氣體,性質非常不穩定,溫度過高或水溶液中ClO
2的質量分數高于30%等均有可能引起爆炸,易與堿液反應生成鹽和水。
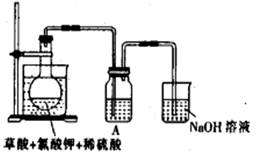
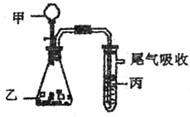
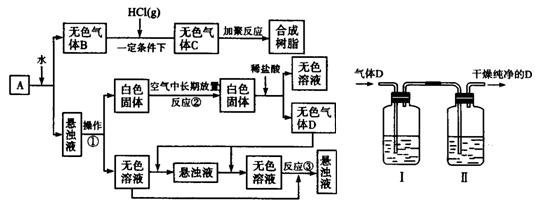
(1)某研究小組設計如圖所示實驗制備ClO
2溶液,其反應的化學方程式為
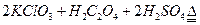
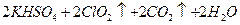
①在反應開始之前將燒杯中的水加熱到80℃,然后停止加熱,并使其溫度保持在60~80℃之間。控制溫度的目的是
,圖示裝置中缺少的一種必須的玻璃儀器是
②裝置A用于溶解產生的二氧化氯氣體,其中最好盛放
(填字母)。
| A.20mL 60℃的溫水 | B.100mL冰水 |
| C.100mL飽和食鹽水 | D.100mL沸水 |
③在燒瓶中加入12.25g KClO
3和9g草酸(H
2C
2O
4),然后再加入足量的稀硫酸,水浴加熱,反應后生成ClO
2的質量為
(2)用ClO
2處理過的飲用水(pH為5.5~6.5)常含有一定量對人體不利的亞氯酸根離子(
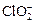
)。飲用水中ClO
2、
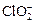
的含量可用連續碘量法進行測定,實驗步驟如下:
步驟1:準確量取一定體積的水樣加入錐形瓶中;
步驟2:調節水樣的pH至7.0~8.0;
步驟3:加入足量的KI晶體;
步驟4:加入少量指示劑,用一定濃度的Na
2S
2O
3溶液滴定至終點;
步驟5:再調節溶液的pH≤2.0;
步驟6:繼續用相同濃度的Na
2S
2O
3溶液滴定至終點。
①步驟1中若要量取20.00mL水樣,則應選用的儀器是
②步驟1~4的目的是測定水樣中ClO
2的含量,其反應的化學方程式為:
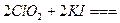
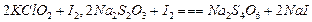
,則步驟4中加入的指示劑為
,滴定達到終點時溶液的顏色變化為
③步驟5的目的是使
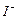
將溶液中的
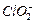
還原為
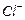
以測定其含量,該反應的離子方程式為:
④若飲用水中
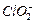
的含量超標,可向其中加入適量的
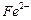
將
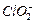
還原為
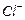
,則該反應的氧化產物為
(填化學式)

 每課必練系列答案
每課必練系列答案 巧學巧練系列答案
巧學巧練系列答案
 確程序 。
確程序 。 餾水
餾水