
【題目】雙羥基鋁碳酸鈉是醫療上常用的一種抑酸劑,其化學式是NaAl(OH)2CO![]() 。關于該物質的說法正確的是( )
。關于該物質的說法正確的是( )
A. 該物質屬于兩性氫氧化物
B. 該物質是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 該藥劑不適合于胃潰瘍患者服用
科目:高中化學 來源: 題型:
【題目】溶液中的反應X+3Y![]() 2Z分別在①、②、③三種不同實驗條件下進行,它們的起始濃度為c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反應物X的濃度隨時間變化如圖所示。②、③與①比較只有一個實驗條件不同,下列說法不正確的是
2Z分別在①、②、③三種不同實驗條件下進行,它們的起始濃度為c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反應物X的濃度隨時間變化如圖所示。②、③與①比較只有一個實驗條件不同,下列說法不正確的是
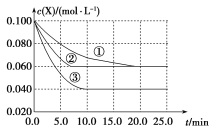
A.反應0~5.0min實驗③的反應速率最快B.條件②的反應最先達到平衡
C.②與①比較,②可能壓強更大D.該反應的正反應是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向氨水中通入![]() ,得到含有
,得到含有![]() 、
、![]() 等物質的溶液,溶液中部分微粒的物質的量分數與pH的關系如圖所示。下列說法正確的是
等物質的溶液,溶液中部分微粒的物質的量分數與pH的關系如圖所示。下列說法正確的是![]()

A.隨著![]() 的通入,溶液中
的通入,溶液中 不斷增大
不斷增大
B.已知常溫下,![]() 的
的![]() 溶液
溶液![]() ,則常溫下
,則常溫下![]()
C.![]() 溶液中存在關系:
溶液中存在關系:![]()
D.![]() 時,溶液中
時,溶液中![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH3CH2OH和 ![]() 互為同分異構體,將兩種物質分別放在下列檢測儀上進行檢測,顯示出的信號完全相同的是
互為同分異構體,將兩種物質分別放在下列檢測儀上進行檢測,顯示出的信號完全相同的是
A.李比希元素分析儀B.紅外光譜儀C.核磁共振儀D.質譜儀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是![]()
A.凡是離子化合物在離子方程式中都要以離子來表示
B.離子互換反應總是向著溶液中離子濃度減小的方向進行
C.酸堿中和反應的實質是![]() 和
和![]() 結合生成水,故酸堿中和反應的離子方程式都是
結合生成水,故酸堿中和反應的離子方程式都是![]()
D.復分解反應必須具備離子反應生成的三個條件才能進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙二酸俗稱草酸![]() 結構簡式為
結構簡式為![]() ,可簡寫為
,可簡寫為![]() ,它是一種重要的化工原料.
,它是一種重要的化工原料.![]() 常溫下
常溫下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 寫出
寫出![]() 的電離方程式______.
的電離方程式______.
![]() 溶液顯酸性的原因是______;向
溶液顯酸性的原因是______;向![]() 的草酸氫鉀溶液里滴加NaOH溶液至中性,此時溶液里各粒子濃度關系正確的是______.
的草酸氫鉀溶液里滴加NaOH溶液至中性,此時溶液里各粒子濃度關系正確的是______.
a.![]()
![]()
![]()
![]()
![]() 與酸性高錳酸鉀溶液反應,現象是有氣泡
與酸性高錳酸鉀溶液反應,現象是有氣泡![]() 產生,紫色消失。寫出反應的離子方程式______;又知該反應開始時速率較慢,隨后大大加快,可能的原因是______.
產生,紫色消失。寫出反應的離子方程式______;又知該反應開始時速率較慢,隨后大大加快,可能的原因是______.
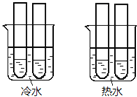
![]() 某同學設計實驗如圖所示:兩個燒杯中的試管都分別盛有2mL
某同學設計實驗如圖所示:兩個燒杯中的試管都分別盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分別混合并振蕩,記錄溶液褪色所需時間.該實驗目的是研究______,但該實驗始終沒有看到溶液褪色,推測原因______.
溶液,分別混合并振蕩,記錄溶液褪色所需時間.該實驗目的是研究______,但該實驗始終沒有看到溶液褪色,推測原因______.
![]() 已知草酸
已知草酸![]() 受熱分解的化學方程式為:
受熱分解的化學方程式為:![]() ,寫出
,寫出![]() 在密閉容器中高溫分解的化學方程式______.
在密閉容器中高溫分解的化學方程式______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】國務院強調,“南水北調”工程必須堅持節水、治污和生態環境保護與工程建設相協調,以水資源合理配置為主線,把節水、治污和生態環境保護與調水作為一個完整的系統來分析的原則。在調水工程中,沿途工業污水的任意排放是造成水質惡化的最大隱患。經檢測,某工廠廢液中含有大量的![]() 、
、![]() 、
、![]() 、
、![]() 。試分析并回答下列問題:
。試分析并回答下列問題:
(1)該廢液中可能大量存在的陰離子是________(填序號)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)為了回收廢液中的金屬銀,某同學設計了如圖所示的實驗方案。若按照該方案獲得金屬銀108g,在保證不污染環境且![]() 循環利用的情況下,可得出理論上應提供標準狀況下的
循環利用的情況下,可得出理論上應提供標準狀況下的![]() ________L。
________L。
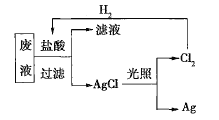
(3)為了實現(2)中氯氣的循環利用,有人設想以氫氣和氯氣為原料利用原電池原理直接制鹽酸,假設這種想法可行,下列說法肯定錯誤的是________(填序號)。
A 兩極材料都用石墨,用稀鹽酸作電解質溶液
B 通入氫氣的電極為原電池的正極
C 電解質溶液中的陽離子向通入氯氣的電極移動
D 通入氯氣的電極的電極反應式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種高效安全的殺菌消毒劑。用氯化鈉電解法生成ClO2的工藝原理示意圖如圖,發生器內電解生成ClO2。下列說法正確的是( )
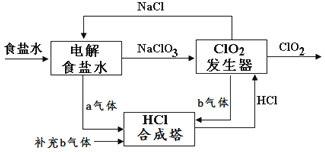
A.a氣體是氯氣,b氣體是氫氣
B.為使a、b氣體恰好完全反應,理論上每生產1molClO2需要補充56L(標準狀況)b氣體
C.ClO2發生器中的還原反應為:2ClO3-+12H++10e-=Cl2↑+6H2O
D.氯化鈉電解槽內每生成2mola氣體,轉移2mole-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,CH3COOH的電離平衡常數Ka=1.75×10-5,NH3·H2O的電離平衡常數Kb=1.75×10-5,現在25 ℃時向10 mL濃度均為0.1 mol·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH變化曲線如圖所示。下列有關說法不正確的是( )
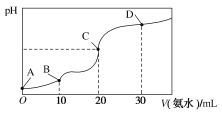
A.A點到B點,溶液的導電性逐漸減小
B.整個過程中,C點處水的電離程度最大
C.pH =7時對應的點應在C點和D點之間,此時溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH)
D.D點處:c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com