
【題目】圖甲為在銅棒上電鍍銀的裝置,圖乙是在圖甲裝置中央放置質量相等的兩個銀圈,用繩子系住(繩子為絕緣體),一段時間后,兩裝置中銅極質量均增重1.08g。下列說法不正確的是
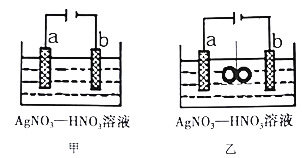
A. 電極a為純銀
B. 圖甲:若b極有標況下112mL紅棕色氣體生成,則電子有效利用率為50%
C. 圖乙:若乙池中無氣體生成,則繩子兩端銀圈質量之差為2.16g
D. 處理銀器表面的黑班(Ag2S),將銀器置于盛有食鹽水的鋁制容器里并與鋁接觸,則Ag2S可以轉化為Ag
【答案】B
【解析】分析: 在銅棒上電鍍銀,金屬銀做陽極,這里就是a極;b電極是陰極,發生還原反應,Ag++e-=Ag,若生成紅棕色氣體NO2,則又發生了NO3-+e-+2H+= NO2↑+H2O;為處理銀器表面的黑斑,將銀器置于鋁制容器里的食鹽水中并與鋁接觸,該裝置構成原電池,食鹽水作電解質溶液,加強溶液的導電性。以此解答。
A. 根據以上分析,圖甲裝置為在銅棒上電鍍銀,電極a做陽極,應為純銀,故A正確;
B. 銅極質量均增重1.08g,生成Ag的物質的量為:![]() =0.01mol,轉移電子也是0.01mol,若b極有標況下112mL紅棕色氣體生成,即生成NO2的物質的量為:
=0.01mol,轉移電子也是0.01mol,若b極有標況下112mL紅棕色氣體生成,即生成NO2的物質的量為:![]() =0.005mol,轉移電子的物質的量為0.005mol,則電子有效利用率為
=0.005mol,轉移電子的物質的量為0.005mol,則電子有效利用率為![]() ×100%=67%,故B不正確;
×100%=67%,故B不正確;
C. 圖乙中左右各形成一個電鍍池,若乙池中無氣體生成,則繩子兩端銀圈左圈為左池的陰極,增重1.08g,右圈為右池的陽極,減重1.08g,兩圈質量之差為2.16g,故C正確;
D. 處理銀器表面的黑班(Ag2S),將銀器置于盛有食鹽水的鋁制容器里并與鋁接觸,該裝置構成原電池,Ag2S作正極被還原為Ag,故D正確。
綜上所述,本題正確答案為B。


科目:高中化學 來源: 題型:
【題目】半導體工業中,有一句行話:“從沙灘到用戶”,即由SiO2制Si。制取過程中不涉及到的化學反應是
A. SiO2+2C![]() Si+2CO
Si+2CO
B. SiO2+2NaOH=Na2SiO3
C. Si+2Cl2![]() SiCl4
SiCl4
D. SiCl4+2H2![]() Si+4HCl
Si+4HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某鐵碳合金中鐵的質量分數,并探究鐵與濃硫酸的反應設計了圖示實驗裝置。

(1)在裝藥品開始實驗前要進行的操作是_____
(2)a 克鐵碳合金中加入過量濃硫酸,未點燃酒精燈前,A 無明顯現象,其原因是常溫下①_____;②_____。
(3)寫出加熱時 A 中碳與濃硫酸發生反應的化學方程式_____。
(4)B 中的現象是:_____;C 的作用是:_____。
(5)待 A 中不再逸出氣體時,停止加熱,拆下 E 并稱重,E 增重 bg。則鐵碳合金中鐵的質量分數為_____(寫含 a、b 的表達式)。
(6)經測定,(5)中測得結果偏小,原因可能是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將0.1 mol的鎂、鋁混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。請回答:
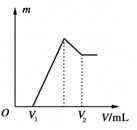
(1)若在滴加NaOH溶液的過程中沉淀質量m隨加入NaOH溶液的體積V變化如上圖所示。當V1=160 mL時,則金屬粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液過程中,欲使Mg2+、Al3+剛好沉淀完全,則滴入NaOH溶液的體積V(NaOH)=________ mL。
(3)若混合物仍為0.1 mol,其中Mg粉的物質的量分數為a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中無Al(OH)3。滿足此條件的a的取值范圍是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 由C(石墨) = C(金剛石) △H=+1.9 kJ·mol-1可知,金剛石比石墨穩定
B. 在一定條件下,等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多
C. 已知2C(s) + O2(g) = 2CO(g) △H=-221 kJ·mol-1,可知C的標準燃燒熱為110.5 kJ·mol-1
D. 在一密閉容器中,9.6 g的硫粉與11.2 g的鐵粉混合加熱,充分反應,生成硫化亞鐵17.6 g,放出19.12 kJ的熱量,則Fe(s) + S(s) = FeS(s) △H= - 95.6 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 硅和C60的熔化克服相同類型作用力
B. 只有活潑金屬元素與活潑非金屬元素之間才能形成離子鍵
C. 等物質的量的CN-和N2含有的共用電子對數相等
D. 氯氣與NaOH溶液反應的過程中,同時有離子鍵、極性鍵與非極性鍵的斷裂和形成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】混合動力汽車(HEV) 中使用了鎳氫電池,其工作原理如圖所示:其中M 為儲氫合金,MH 為吸附了氫原子的儲氫合金,KOH 溶液作電解液。關于鎳氫電池,下列說法不正確的是

A. 充電時,陰極附近pH 降低
B. 電動機工作時溶液中OH-向甲移動
C. 放電時正極反應式為:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 電極總反應式為:MH+NiOOH![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產上用過量燒堿溶液處理某礦物(含Al2O3、MgO),過濾后得到的濾液用 NaHCO3溶液處理,測得溶液pH、n[Al(OH)3]隨加入NaHCO3溶液體積變化的曲線如下圖所示。下列有關說法不正確的是
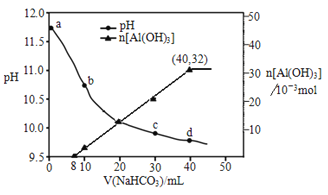
A. 生成沉淀的離子方程式為HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 點與c點溶液所含微粒種類相同
C. a 點溶液中大量存在的離子是Na+、AlO2-、OH-
D. NaHCO3溶液的物質的量濃度為0.8mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物如NH3及銨鹽、N2H4、N2O4等在中學化學、化工工業、國防等領域占有重要地位。
(1)發射航天火箭常用肼(N2H4)與N2O4作燃料與助燃劑。肼(N2H4)與N2O4的反應為2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相關反應的化學鍵鍵能數據如下表所示:
化學鍵 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
則使1mol N2O4(g)分子中化學鍵完全斷裂時需要吸收的能量是___________。
(2)N2O4與NO2之間存在反應N2O4(g)![]() 2NO2(g)。將一定量的N2O4放入恒容密閉容器中,測得其平衡轉化率[a(N2O4)]隨溫度的變化如圖所示。
2NO2(g)。將一定量的N2O4放入恒容密閉容器中,測得其平衡轉化率[a(N2O4)]隨溫度的變化如圖所示。

①由圖推測該反應的△H ___0(填“>”或“<”),理由為________________。
②圖中a點對應溫度下,已知N2O4的起始壓強po為108 kPa,則該溫度下反應的平衡常數Kp=_________(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③在一定條件下,該反應N2O4、NO2的消耗速率與自身壓強間存在關系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是與反應溫度有關的常數。相應的速率壓強關系如圖所示,一定溫度下,k1、k2與平衡常數Kp的關系是k1=___________,在下左圖上標出的點中,能表示反應達到平衡狀態的點為__________(填字母代號)。

(3)電解NO2制備NH4NO3,其工作原理如圖所示。

①陽極的電極反應式為________________________________________。
②為使電解產物全部轉化為NH4NO3,需補充某種化合物A,則A的化學式為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com